Bag3-P209L信号机制的发现为目前正在开发的治疗方案带来了希望
肌纤原性肌病(MFM)是一组罕见的遗传性疾病,引起骨骼肌和心肌无力。据报道,横纹肌中高度表达的bcl2相关的凋亡基因3 (Bag3)蛋白突变可导致一种特别严重的MFM。作为一种小的热休克蛋白,Bag3的功能是维持肌肉细胞内的结构支持和蛋白质质量控制过程。相反,突变的Bag3通过未知的机制导致进行性心脏和骨骼肌无力。迄今为止,已经报道了10多种Bag3突变导致MFM,其中许多具有影响心肌的特别严重的表型。最常见的Bag3突变是脯氨酸-209-亮氨酸(P209L)突变,它会导致严重的儿童期MFM并发心肌病。为了描述Bag3 P209L突变如何导致患者心肌病,我们建立了一种转基因小鼠模型(Bag3-P209L Tg+小鼠),在心肌细胞中只表达人Bag3-P209L。

图1所示。人Bag3-P209L表达对Bag3-P209L Tg+小鼠心肌细胞的影响。A.正常、健康的心肌细胞显示健康的线粒体和野生型Bag3的适当胞质定位,未检测到前淀粉样蛋白低聚物(PAOs)。B.在12月龄时,表达Bag3- p209l的心肌细胞表现为心肌细胞肥大,成纤维细胞面积(数量和/或大小)增加,野生型Bag3水平降低,线粒体碎片化增加(线粒体变小),PAOs,成纤维细胞存在增加,收缩/舒张心功能障碍(心力衰竭)表型。
这些Bag3-P209L Tg+小鼠在8个月大时开始表现出心功能障碍,在12个月大时心脏功能逐渐下降,但没有任何死亡。在细胞水平上,我们发现了与已知心脏衰竭特征一致的缺陷和重塑,包括心肌细胞增大(肥大)、线粒体功能障碍、代谢改变和心脏成纤维细胞存在增加(图1)。此外,我们发现在Bag3- p209l Tg+小鼠中,在突变Bag3存在时,正常Bag3下调。总的来说,这些数据揭示了与人类疾病相当的扩张型心肌病表型。
我们对MFM患者中已知遗传原因(包括Bag3-P209L突变)导致心肌病的机制知之甚少。这些疾病的一个共同特征是肌肉细胞内存在错误折叠的蛋白质,称为前淀粉样蛋白低聚物(PAOs)。PAOs是细胞内形成大聚集体的可溶性错误折叠中间体。实验和临床证据表明,PAOs具有细胞毒性(损伤和杀死细胞),在机制上促进了常见神经退行性疾病的病理生理,包括阿尔茨海默病和帕金森病。在我们的研究中,我们发现突变体Bag3-P209L在一岁时在心肌细胞中表达并积聚形成PAOs。因此,我们假设心脏Bag3-P209L PAOs在机制上引起心功能障碍的进行性发展,与阿尔茨海默病和其他神经退行性疾病的潜在机制相似,其中PAOs直接诱导神经元功能障碍和死亡。
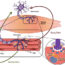
在神经退行性疾病的发病机制中,PAOs被假设激活p38 MAPK信号,引发细胞损伤和死亡。抑制p38已显示出逆转神经元蛋白毒性的治疗潜力,包括p38抑制剂,目前正在临床试验中用于治疗阿尔茨海默病(clinicaltrials.gov标识符:NCT02423200, NCT02423122)。我们假设p38在Bag3-P209L Tg+小鼠的心脏中增加,以驱动心肌细胞损伤和心肌病的发生。当我们在一岁时询问Bag3-P209L Tg+心脏时,我们发现p38显著激活,同时体内收缩和舒张功能障碍。这使得我们在Bag3-P209L Tg+小鼠中提出了一种疾病模型,该模型与神经退行性疾病的明确发病机制相似(图2)。Bag3-P209L在心肌细胞内错误折叠导致PAO形成,随后激活的p38增加。激活p38的增加导致肌肉细胞死亡和心功能障碍。此外,Bag3-P209L可能直接与p38相互作用,增加活化的p38水平,促进疾病持续进展。

图2所示。提出心肌细胞内Bag3-P209L突变引起心肌病的机制。a . P209L突变是导致Bag3结构中单个氨基酸改变的点突变。B. Bag3-P209L表达导致心肌细胞内PAO形成。细胞毒性PAOs通过激活p38的增加激活应激信号,导致细胞死亡和心功能障碍。
这些发现表征了bag3相关MFM的第一个临床前模型,并确定了导致Bag3-P209L突变导致疾病的潜在机制。重要的是,这些数据确定p38是目前尚无治疗方法的bag3相关MFMs的治疗干预的潜在靶点。
山姆伊顿1,2,蒙特·s·威利斯1,2
1病理与检验医学系血管生物学综合训练计划,
北卡罗来纳大学,教堂山,北卡罗来纳州,美国
2美国北卡罗来纳大学教堂山分校药学系
出版
心肌细胞特异性人bcl2 -相关Anthanogene 3 P209L表达诱导线粒体断裂、bcl2 -相关Anthanogene 3单倍性不足并激活p38信号传导
Quintana MT, Parry TL, He J, Yates CC, Sidorova TN, Murray KT, Bain JR, Newgard CB, Muehlbauer MJ, Eaton SC, Hishiya A, Takayama S, Willis MS
2016年8月











留言回复
你一定是登录发表评论。