淀粉样原纤维的新形态
此前已有研究表明,酿酒酵母细胞壁中的一种蛋白质(葡聚糖转移酶Bgl2)在酸性pH条件下从细胞壁分离出来后形成淀粉样结构。众所周知,酵母细胞的酸处理导致细胞凋亡表型的发生,并诱导一般的应激反应途径,其中可能包括细胞壁完整性控制的机制。利用生物信息学分析,研究了Bgl2p序列中潜在的淀粉样蛋白形成区域产生淀粉样蛋白的能力。

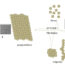
图1所示。AspNB制备过程中电场片段的EM图像。样品(0.4 mg/ml)置于5%醋酸(5% DMSO)中,37℃孵育30小时:(A)原纤维以宽带状形式横向结合;(B)两根原纤维在其侧面相连;(C)两根原纤维通过其侧面接触Formvar支架;(D)成束的原纤维;(E, F)成束形式的原纤维碎片。环状低聚物随机结合(E,箭头)。
分析潜在的淀粉样蛋白区形成淀粉样蛋白的能力,了解淀粉样蛋白特性对不同条件(合成、pH、温度、离子强度等)的依赖性,对于理解蛋白质中淀粉样蛋白形成的一般机制非常重要。通过不同的方法研究了Bgl2中预测的淀粉样蛋白片段AspNB(残基166 ~ 175,末端无阻断的VDSWNVLVAG)和GluNB 2位谷氨酸取代天冬氨酸的同源肽(VESWNVLVAG)的淀粉样蛋白形成过程。通过比较两种肽的数据,我们得出结论,D取代E影响了淀粉样蛋白的形成过程:AspNB比GluNB更快地形成淀粉样蛋白原纤维。然而,这种突变对成熟淀粉样蛋白原纤维的形态没有影响。
对两种制剂原纤维形态的详细分析显示,原纤维具有很强的多态性(图1)。肽形成不同宽度的条带,不同时期的扭曲条带,不同直径的原纤维束。此外,我们还发现了文献中未提及的新的形态学原纤维(图2,С4)。这种形态类似于并排躺在一起的蛇,没有缠绕在一起。
EM研究最重要的结果是,尽管原纤维具有很强的多态性,但在所有情况下,任何形态的原纤维的主要构建元素都是环状低聚物,其外径约为6-8 nm,内径(孔)约为2-3 nm,高度约为3-4 nm(根据单个原纤维的弯曲位点估计(图1))。这种低聚物相互结合,或者是环对环,或者是稍微重叠在一起。
x射线分析数据表明,环状低聚物形成的原纤维具有交叉β结构。这与我们提出的低聚物结构模型和低聚物在原纤维中的包装机制一致。根据提出的模型,环状低聚物包括β-链和12个β-片。这个量足以产生交叉β结构的反射特性。
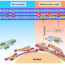
根据简化方案,原纤维的形成过程如下:单体→不稳定单体→低聚物→原纤维。这个方案最薄弱的地方是低聚物。对于许多淀粉样蛋白或多肽,在纤维形成的初始阶段可以观察到低聚物;低聚物(Aβ肽,胰岛素)通常具有环状形态。目前尚不清楚在“低聚物→原纤维”阶段发生了什么。环状低聚物是如何形成原纤维的?我们认为低聚物很可能是原纤维的基本单位。环状低聚物可以形成纤维的任何形态,即在一定条件下,同一制备的原纤维的多态性可以用不同的低聚物相互作用方式来解释(图2)。即使在不同的原纤维形成条件(pH、离子强度、温度等)发生变化时,也更容易解释原纤维形态的变化。

图2所示。原纤维多态性示意图。(一)单体;(B)低聚物;(C)单纤维。低聚物的形成:1)带状;2)细束;3)大直径束;淀粉样原纤维的新形态。(D)环状低聚物在原纤维中堆积的分子模型(俯视图和侧视图); (E) the corresponding EM images.
可以假设Bgl2p也是构象不稳定的。Bgl2p在不同条件下(在培养基中或从细胞壁分离后在水中)形成各种形态(网状或束状)的能力证实了这一假设。
奥尔加·m·塞利万诺娃1,Alexey K. Surin1,Tatyana S. Kalebina2,Oxana V. Galzitskaya1
1俄罗斯科学院蛋白质研究所官方manbetx手机版
2莫斯科国立大学生物学院分子生物系
出版
酿酒酵母细胞壁bgl2p -葡聚糖转移酶淀粉样蛋白原纤维的结构模型及其修饰类似物。淀粉样原纤维的新形态。
Selivanova OM, Glyakina AV, Gorbunova EY, Mustaeva LG, Suvorina MY, Grigorashvili EI, Nikulin AD, Dovidchenko NV, Rekstina VV, Kalebina TS, Surin AK, Galzitskaya OV
生物化学,2016年11月










留言回复
你一定是登录发表评论。