一种新的T细胞调节因子的鉴定
t细胞受体(TCR)信号是由蛋白酪氨酸激酶(如p56)的激活介导的lck和zap - 70。在成熟的t细胞中,CD4和CD8分子与p56结合lck然后磷酸化TCR相关CD3亚基中的细胞内免疫受体酪氨酸激活基序(ITAM),以募集ZAP-70。ZAP-70介导的76 kDa (SLP-76)酪氨酸残基113、128和145的接头蛋白Src同源2结构域的磷酸化是一个关键的TCR信号事件。缺乏ZAP-70的细胞减少了SLP-76的磷酸化,其他可能磷酸化SLP-76的蛋白激酶的身份仍然未知。SLP-76通过将抗原受体(TCR)信号连接到下游途径,在t细胞活化中起着至关重要的作用。除了三个关键酪氨酸(Y113, Y128和Y145,或“3Y”)外,SLP-76在其n端也有一个不育α基序(SAM)结构域,其功能尚不清楚。

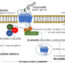
图1所示。当抗原(TCR/CD3)和CD4/8表面受体与同源mhc -肽复合物结合在抗原呈递细胞上时,在T细胞膜上启动信号级联反应。p56lck被募集到CD4/8上,导致TCR/CD3 ITAM基序(黑色条带)的酪氨酸磷酸化,为ZAP-70募集TCR/CD3-zeta位点。ZAP-70磷酸化ITAM基序和SLP-76近端酪氨酸。在这项研究中,我们发现了一种新的T细胞激酶调节因子ACK1 (Activated Cdc42-associated kinase 1)。ACK1结合并磷酸化SLP-76 n端酪氨酸,导致钙通量和NFAT活性增加,这是T细胞活化的标志。ACK1上游的信号通路仍有待探索。
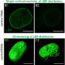
我们之前的研究表明,SAM结构域有两个结合区域,介导T细胞中SLP-76的二聚体和低聚体的形成。n端SAM结构域对最佳胸腺分化和T细胞活化至关重要。尽管取得了这些进展,SAM域功能的机制仍然不清楚。在这项研究中,我们研究了SLP-76 SAM结构域与其他携带SAM结构域的蛋白质相互作用的能力。我们研究了从人类激酶组中检索到的Sugen/Salk激酶数据库(KinBase)中的激酶,这些激酶含有几种具有n端SAM结构域的SAM激酶。我们推断,n端结构域可能已经进化出了与其他n端结构域相互作用的能力。这导致了激活细胞分裂周期42 (Cdc42)相关酪氨酸激酶1 (ACK1;也被称为Tnk2,酪氨酸激酶非受体2),是一种以sam依赖的方式与SLP-76结合并调节其磷酸化和t细胞信号传导的激酶。此外,这种相互作用是由抗tcr连接引起的,并被SLP-76 SAM结构域的缺失(ΔSAM)或Y113、Y128和Y145突变为苯丙氨酸(3Y3F)所消除。ACK1诱导依赖于SAM结构域的SLP-76 n端酪氨酸(3Y)磷酸化。 ACK1 also promoted calcium flux and NFAT-AP1 promoter activity and decreased the motility of murine CD4+原代t细胞在icam -1包被的板上,这一事件被ACK1的小分子抑制剂(AIM-100)逆转。这些发现确定ACK1是一种新的SLP-76相关蛋白酪氨酸激酶,可调节t细胞的早期活化事件。
谢伊,费尔南德斯N,陆克C
剑桥大学,英国
哈佛医学院,美国
英国埃塞克斯大学
蒙特利尔大学,蒙特利尔,魁北克,加拿大
Maisonneuve-Rosemont医院,蒙特利尔,魁北克,加拿大
出版
活化的cdc42相关激酶1 (ACK1)结合接头SLP-76的SAM结构域并磷酸化近端酪氨酸。
Thaker YR, Recino A, Raab M, Jabeen A, Wallberg M, Fernandez N, Rudd CE
生物化学学报,2017年2月10日











留言回复
你一定是登录发表评论。