EGFR变构降解物导致癌细胞脱离-促进死亡
表皮生长因子受体(EGFR)变构酪氨酸激酶抑制剂(TKIs)已成为克服癌症耐药的治疗选择。我们已经开发了4-烯丙基-5-[2-(4-烷氧苯基)-喹啉-4-基]- 4h -1,2,4-三唑-3-硫醇的糠基衍生物,并表明这些化合物与EGFR催化位点附近的变构袋结合,并对酪氨酸磷酸化提供弱抑制,但增加受体降解。至关重要的是,新化合物的抗癌作用依赖于两种不同的途径,即egfr启动的内吞作用和导致细胞脱离细胞外基质(ECM)并最终导致癌细胞死亡的细胞骨架机制的瓦解。所研究的五种化合物VM21 - VM26的细胞毒性与蛋白质降解和细胞脱离有关,这是由于变构口袋中的疏水相互作用,这取决于结合化合物中烷基醚链的长度。
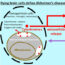
在健康细胞中,活化的EGFR经历内吞作用,被归类为微自噬,随后由融合到内体的溶酶体中的蛋白水解酶回收或降解受体。EGFR控制MAPK/ERK通路,导致传感器蛋白Bim磷酸化,Bim随后与微管和肌动蛋白结合,以确保细胞骨架的完整性和α/β-整合素附着在ECM上。因此,bim介导的细胞骨架磷酸化是anoikis的一个组成部分,anoikis是由细胞脱离引起的程序性凋亡死亡。与健康细胞相比,癌细胞对脱离有更高的耐受性。
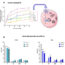
我们的多功能杂环化合物被认为是可逆的和弱ATP竞争者,仅在短时间内抑制EGFR磷酸化。然而,从自噬特异性蛋白LC3β数量的增加可以判断,变抗化合物与EGFR的结合允许受体的快速内吞降解。EGFR的耗尽导致Bim的隔离,随后细胞骨架蛋白β-肌动蛋白和α-微管蛋白的降解,导致细胞脱离ECM和细胞死亡。与β-肌动蛋白和溶酶体蛋白酶LAMP-2相比,EGFR数量的早期下降证实了两个不同过程的关系,受体的快速内吞降解与随后细胞骨架的缓慢衰变。
变抑降解剂也显著抑制了BimEL中Ser69的磷酸化,这与EGFR磷酸化的降低有关,无论在生长培养基中添加EGF、谷氨酰胺,还是两者都添加。谷氨酰胺饥饿导致ATP缺乏加速和增强自噬蛋白降解。鉴于谷氨酰胺在细胞中的多重作用,包括向EGFR提供大量磷酸基团以支持下游信号通路的磷酸化,这种关系可以概括为“没有谷氨酰胺,就没有EGFR信号传导”。
我们的变构性EGFR降解物已被证明在三阴性乳腺癌、前列腺癌和非小细胞肺癌细胞中具有活性。用这些药物治疗的小鼠也显示出肿瘤生长抑制作用。新型抗egfr药物的作用机制如图1所示。
化疗中断MAPK/ERK磷酸化通量被认为是减少癌症进展的一种有希望的手段。经典的和变构的EGFR TKIs被描述为阻断蛋白磷酸化,在癌细胞中提供治疗效果。与这些药物相比,我们的强效变甾体表皮生长因子受体降解剂,虽然是弱抑制剂,可能会对相关信号传导和代谢途径造成较小的破坏,并打开凋亡途径,导致更有选择性地破坏癌细胞。因此,有希望的EGFR变构降解物对于开发替代疗法以减少耐药性,减少患者的有害副作用和防止侵袭性肿瘤的转移性扩散具有很大的兴趣。
Melkon Iradyan1,尼娜Iradyan1,Vehary Sakanyan2
1精细有机化学研究所有机与药物化学科学技术中心,
亚美尼亚共和国国家科学院,埃里温,亚美尼亚
2南特大学,药学院,法国南特
出版
通过变构位点靶向EGFR降解导致癌细胞脱落-促进死亡
Melkon Iradyan, Nina Iradyan, Philippe Hulin, Artur Hambardzumyan, Aram Gyulkhandanyan, Rodolphe Alves de Sousa, Assia Hessani, Christos Roussakis, Guillaume Bollot, Cyril Bauvais, vehari Sakanyan
癌症(巴塞尔)。2019年8月1日










留言回复
你一定是登录发表评论。