体外模拟淋巴细胞迁移的介绍
淋巴细胞向炎症内皮细胞(EC)的募集是免疫稳态的基础——提供细胞介导的疾病防御,同时也有助于炎症的解决。然而,淋巴细胞和EC之间的动态关系在疾病中可能变得失调。在炎症环境中,我们可以识别并最终调节免疫失调的关键参与者,但这样做需要准确在体外白细胞粘附和迁移的建模。

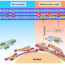
图1所示。(A)未经处理的EC,或(B)完成淋巴细胞粘附/迁移试验后TNF-α和IFN-γ刺激的EC的相衬显微照片。淋巴细胞在37⁰C的EC上沉淀6.5分钟,成像前将非贴壁细胞洗掉并在2%戊二醛中固定。表面贴壁淋巴细胞呈相亮和圆形(白色箭头),而迁移细胞呈相暗(红色箭头),可在EC下方看到扩散和不规则形状。细胞在迁移过程中可能会出现相亮、相灰或相暗的组合(绿色箭头)。
在我们的实验室中,我们使用培养的内皮单层作为模型,研究了围绕白细胞穿过内皮并进入炎症组织的迁移事件(图1A)。为了研究淋巴细胞运输,EC单层可以用炎症细胞因子如肿瘤坏死因子-α (TNF-α)和干扰素-γ (IFN-γ)处理24小时。这使我们能够模拟淋巴细胞浸润处的炎症程度;相比之下,在模拟中性粒细胞迁移时,TNF-α仅刺激EC 4小时(中性粒细胞迁移发生早于淋巴细胞迁移)。在静态粘附试验中,将新鲜分离的全血淋巴细胞添加到细胞因子刺激的EC单层上6.5分钟。流动条件下淋巴细胞募集的测量也可以通过在市售微通道中培养EC来实现。这些基于流动的黏附系统可以实时观察淋巴细胞与内皮细胞在不同流动或壁剪切速率下的相互作用,使我们能够模拟各种血管类型在体外。为了更好地模拟生理条件,静态和流动实验均在37°C下进行。重要的是,在细胞共培养后,静态测定用2%等渗戊二醛固定;这使得化验板可以长期储存,以备后期成像。在流动或静态条件下,相衬成像可以区分粘附淋巴细胞的不同命运(图1B)。静态分析可以获得广泛的信息,包括总贴壁细胞计数,跨内皮迁移的百分比变化和非固定板的迁移速度。此外,基于流动的分析可以记录单个细胞在初始捕获和滚动过程中的详细信息,它们的粘附相互作用的稳定性以及它们通过内皮单层的迁移过程。
黏附试验是一种多用途的制剂,可以修改以检查其他免疫细胞的募集,如单核细胞或中性粒细胞。所述胶粘剂基材不限于EC;其他人使用其他类型的细胞来评估它们驱动细胞招募的能力(如基质细胞和癌细胞)。静态粘附分析的通用性特别使它们更适合于高通量分析。静态分析只需要很少的专业设备或时间,并允许用户在大量潜力中有效地确定可行的治疗条件或药剂。虽然稍微复杂,基于流动的黏附分析模型在活的有机体内条件更紧密,它们的使用更适合于目标验证。

图2所示。脂联素刺激b淋巴细胞抑制t淋巴细胞跨内皮迁移的示意图概述。1)脂联素通过脂联素受体1和2 (AdipoR1/2)刺激b淋巴细胞。2)脂联素刺激引起b细胞分泌肽抑制剂(PEPtide inhibitor of trans-endothelial migration, PEPITEM)。3) PEPITEM与EC表面表达的Cadherin-15 (CDH-15)相互作用。4) CDH-15的激活刺激EC通过S1P转运蛋白spinster同源物2 (SPSN2)局部分泌鞘氨醇-1-磷酸(S1P)。5) S1P与t淋巴细胞上的S1P受体4结合,下调α l - β2整合素粘附受体的亲和力。6) α l - β2失活抑制t淋巴细胞跨内皮迁移。
我们的实验室使用了静态和流动黏附实验来进一步证明脂肪细胞衍生的肽激素、瘦素和脂联素的抗炎作用。脂联素负责脂肪酸和葡萄糖的代谢,而瘦素则通过调节饱腹感来维持体重。我们观察到,在没有炎症的情况下,瘦素增加了淋巴细胞通过EC单层的迁移。我们还发现脂联素参与了t淋巴细胞转运的调控。脂联素刺激b淋巴细胞衍生肽的产生,该肽通过诱导内皮鞘鞘醇-1-磷酸间接下调粘附分子对t淋巴细胞的亲和力(图2)。脂联素的作用已得到进一步验证。在活的有机体内和在体外。这表明……的不可缺少的作用在体外多细胞系统的建模有助于免疫细胞募集过程中靶点的发现。
侯赛因MT,奇曼M
医学和牙科学院心血管科学研究所,
英国伯明翰大学,伯明翰,b152tt
出版
体外淋巴细胞运输的内分泌调节。
Apta BH, Chimen M, Mcgettrick HM
方法《Mol Biol》,2017










留言回复
你一定是登录发表评论。