半胱氨酸残基是ALS中sod1相关神经元毒性的关键指挥官
肌萎缩性侧索硬化症;肌萎缩性侧索硬化症(Lou Gehrig’s disease)是一种危及生命的运动神经元疾病,它会逐渐影响全身的肌肉力量。该疾病在某些情况下发生家族性,25 - 30%的家族性病例是由Cu, zn -超氧化物歧化酶(SOD1)基因突变引起的。
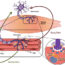
在SOD1基因突变致ALS的发病机制中,由该基因产生的突变SOD1蛋白可能呈现与野生型SOD1蛋白不同的异常结构(即错误折叠),从而形成聚集体产生异常沉积物,对神经元细胞产生毒性。
 我们之前用培养细胞证明了,111th与野生型SOD1相比,突变型SOD1的氨基酸半胱氨酸残基(Cys111)容易发生氧化修饰,这导致突变蛋白错误折叠,从而增强其对神经元细胞的毒性(Watanabe S等)。中国生物医学工程学报(英文版),2009,30 - 34,等。自由基生物医学杂志48,945-952,2010)。因此,我们在本研究中使用该疾病的模型小鼠来检测突变体SOD1的Cys111是否对该蛋白的毒性产生ALS表型至关重要。
我们之前用培养细胞证明了,111th与野生型SOD1相比,突变型SOD1的氨基酸半胱氨酸残基(Cys111)容易发生氧化修饰,这导致突变蛋白错误折叠,从而增强其对神经元细胞的毒性(Watanabe S等)。中国生物医学工程学报(英文版),2009,30 - 34,等。自由基生物医学杂志48,945-952,2010)。因此,我们在本研究中使用该疾病的模型小鼠来检测突变体SOD1的Cys111是否对该蛋白的毒性产生ALS表型至关重要。
首先,我们产生了表达人类SOD1的小鼠,其中通过将组氨酸替换为精氨酸引入als相关突变(H46R SOD1小鼠)。H46R SOD1小鼠在大约5个月时开始出现运动症状。然后,这些老鼠在大约6个月大的时候表现出进行性瘫痪,结束了它们的生命。接下来,我们产生了表达SOD1的小鼠,其中Cys111被替换为丝氨酸残基和H46R突变(H46R/C111S SOD1小鼠)。我们发现H46R/C111S SOD1小鼠大约需要12个月才能出现运动症状。此外,它们的生存时间也延长到14个月,如图所示。在症状期H46R SOD1小鼠脊髓中检测到SOD1 Cys111氧化,SOD1错误折叠和聚集,运动神经元数量减少。另一方面,在相同年龄的H46R/C111S SOD1小鼠中,未见SOD1错误折叠或聚集,反映脊髓中保留了运动神经元。我们的研究首次清楚地表明SOD1的Cys111在SOD1突变的ALS发病机制中起着重要作用,抑制Cys111的氧化可能是开发新的治疗方法的一个有希望的策略。
Seiichi长野一个ndToshiyuki荒木
外周神经系统研究室官方manbetx手机版
国家神经科学研究所,国家神经病学和精神病学中心
日本东京
出版
半胱氨酸残基影响小鼠突变SOD1的构象状态和神经元毒性:与ALS发病机制相关
长野S,高桥Y,山本K,增谷H,藤原N,漆谷M,荒木T。
2015年6月15日











留言回复
你一定是登录发表评论。