电压门控钾通道,Kv1.3,在胶质瘤中神经胶质功能的十字路口
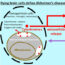
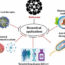
多形性胶质母细胞瘤(GBM)是成人中最致命的癌症之一,发病率为6:10万人。尽管目前有包括手术、放疗和化疗在内的三种治疗方式,但GBM患者的临床结果仍然很差,诊断后的中位总生存期不到15个月。肿瘤快速进展的一个原因是它能够在周围的脑实质中迁移,逃避局部的稳态检查点。这发生在(至少)两步机制中:最初GBM细胞诱导脑胶质细胞的保护反应。因此,星形胶质细胞和小胶质细胞激活以保护脑实质免受GBM产生的有毒分子(如谷氨酸和金属蛋白酶)的伤害。随后,随着GBM的生长,肿瘤源性因子诱导免疫抑制微环境,改变胶质细胞向促瘤表型的反应性,同时产生和释放额外的细胞因子、趋化因子、活性氧、一氧化氮和生长因子,从而维持和促进胶质瘤的生长和侵袭。在肿瘤微环境中高度表达并可能参与肿瘤细胞生长和侵袭的分子中,我们考虑了电压依赖性钾通道Kv1.3。在生理条件下,该蛋白在中枢神经系统的不同区域通过星形胶质细胞和小胶质细胞表达,并且在GBM细胞上也高度表达。
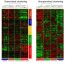
在这项研究中,我们利用了Kv1.3的特异性抑制剂,5-(4-phenoxybutoxy)补骨脂素(PAP-1)。在体外, pap1显示神经保护作用,重新激活星形胶质细胞的谷氨酸缓冲活性,可能减少主要谷氨酸转运体GLT-1的聚合化,GLT-1需要这种翻译后修饰才能在内质网进行加工,而不是在谷氨酸摄取时在质膜上保持活性。此外,Kv1.3对星形胶质细胞的抑制还可影响血脑屏障(BBB)蛋白的内皮表达,从而维持GBM中血脑屏障的完整性。Kv1.3阻断也对小胶质细胞进行了研究,其中PAP-1治疗降低了GBM的吞噬活性和细胞过程运动,至少在一定程度上损害了小胶质细胞与肿瘤细胞的通讯。此外,除了这种间接活性外,PAP-1通过阻断细胞迁移所需的细胞体积变化,直接降低胶质瘤细胞的侵袭性。所有这些在体外观察结果促使我们测试Kv1.3阻断的效果在活的有机体内在小鼠胶质瘤模型中,将GL261细胞(小鼠胶质瘤细胞系)移植到C57BL/6N小鼠的大脑中。根据在体外我们观察到,与未治疗的小鼠相比,用PAP-1治疗胶质瘤小鼠可显著减少肿瘤体积,最多可减少70%。总之,这些发现(图1)表明,Kv1.3通道可能是减少GBM细胞运动的潜在靶点,并对胶质细胞进行再教育,使其具有保护、抗肿瘤活性,减少GBM中的脑实质侵袭和组织损伤。
朱塞皮娜·达历山德罗,克里斯蒂娜·利马托拉,米里亚姆·卡塔拉诺
意大利罗马萨皮恩扎大学生理与药学系
出版
Kv1.3活性扰乱胶质瘤中星形胶质细胞的稳态特性。
Grimaldi A, D 'Alessandro G, Di Castro MA, Lauro C, Singh V, Pagani F, Sforna L, Grassi F, Di Angelantonio S, Catacuzzeno L, Wulff H, Limatola C, Catalano M
2018年5月16日









留言回复
你一定是登录发表评论。