肿瘤微环境中MCP-1产生的机制:肿瘤细胞不是单独的
当你看到肿瘤时,你可能会认为它们100%是由肿瘤细胞组成的。事实是,肿瘤组织不仅包含肿瘤细胞,还包含各种非肿瘤基质细胞,包括成纤维细胞、内皮细胞和炎症细胞(图1)。肿瘤细胞与基质细胞的相互作用导致一系列介质的产生,这些介质为肿瘤细胞生长、侵袭和转移提供了土壤。这些介质包括基质金属蛋白酶、生长因子、细胞因子和趋化因子。单核细胞趋化蛋白-1 (MCP-1,也称为CCL2)是一种76个氨基酸的蛋白,属于调节白细胞运输的蛋白(趋化因子)家族。MCP-1的主要活性是招募血液单核细胞进入炎症和肿瘤部位。由于肿瘤中MCP-1的产生促进了具有免疫抑制和促瘤作用的巨噬细胞(即肿瘤相关巨噬细胞,tumor associated macrophages, tam)的积累,因此MCP-1已成为癌症治疗的分子靶点。
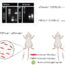
我们在实验室中使用的许多肿瘤细胞系在没有额外刺激的情况下产生MCP-1;因此,肿瘤细胞最初被认为是这种蛋白在已建立的肿瘤中的主要来源。然而,最近的研究强烈表明,在某些肿瘤中,基质细胞是MCP-1的主要细胞来源。肿瘤中MCP-1产生增加的潜在机制有三种;1) MCP-1的产生是由肿瘤细胞组成的,2)肿瘤细胞对刺激的反应增加了MCP-1的产生,3)基质细胞对MCP-1的产生是通过与肿瘤细胞的相互作用增加的。我们最近尝试用两种小鼠肿瘤模型来确定肿瘤中MCP-1产生的机制;4T1乳腺癌和Lewis肺癌(LLC)模型(图2)。
在4T1肿瘤中,MCP-1的主要来源是非肿瘤基质细胞,基质细胞来源的MCP-1促进4T1细胞自发向肺转移。4T1细胞即使受到强效肿瘤细胞激活剂(如toll样受体4配体脂多糖或细胞因子肿瘤坏死因子)的刺激,也不能产生高水平的MCP-1。相反,它们产生并释放粒细胞-巨噬细胞集落刺激因子(GM-CSF,也称为集落刺激因子-2),激活巨噬细胞产生高水平的MCP-1。这只是该模型中的一种机制,还涉及其他尚未确定的机制。
相反,在LLC肿瘤中,活化的肿瘤细胞是MCP-1的主要来源。在这种情况下,肿瘤细胞产生并释放一种未知分子,激活巨噬细胞产生和释放TNF。如上所述,TNF是一种有效的肿瘤细胞激活剂,巨噬细胞来源的TNF诱导LLC细胞产生高水平的MCP-1。与4T1细胞不同,LLC细胞产生MCP-1的能力更大,导致该肿瘤中的MCP-1水平远高于4T1肿瘤。

图2所示。MCP-1在4T1和LLC肿瘤中的产生机制。A. 4T1细胞产生MCP-1的能力较低。然而,它们能够激活基质细胞产生足够数量的MCP-1用于肺转移。例如,它们产生并释放GM-CSF,从而上调巨噬细胞产生MCP-1和其他细胞因子/趋化因子。活化的CAFs和内皮细胞可能是MCP-1的额外来源。CAF,癌症相关成纤维细胞;EC,内皮细胞;TAM,肿瘤相关巨噬细胞。B. LLC细胞含有激活KrasG12C突变,该突变导致组成型MCP-1的产生。 An unidentified product of LLC cells activates TAMs to produce and release TNF. This TNF activates LLC cells to further up-regulate MCP-1 production. The level of MCP-1 produced by LLC tumors is much higher than that by 4T1 tumors.
通过研究肿瘤微环境中MCP-1产生的机制,我们了解了肿瘤细胞与基质细胞沟通的两种不同方式。然而,即使在这两种模型中,我们也没有确定肿瘤细胞-基质细胞相互作用的所有机制。肿瘤细胞可能在其他类型的肿瘤中使用额外的机制来获益。我们还了解到,4T1细胞转移到肺部所需的MCP-1水平并不是很高,这就提出了一种可能性,即在癌症患者中检测到的高水平MCP-1可能只是反映了肿瘤细胞的特性。我们的最终目标是确定肿瘤细胞与基质细胞相互作用的机制,以创造促进肿瘤的微环境,并为挽救癌症患者的生命提供新的手段。
Teizo Yoshimura
北京医科大学研究生院病理与实验医学教研室
日本冈山大学牙科与药学专业
出版
肿瘤微环境中单核细胞趋化蛋白-1 (MCP-1)/CCL2的产生
Yoshimura T
细胞因子。2017年10月













留言回复
你一定是登录发表评论。