人类蛋白磷酸酶:蛋白质组学的见解
蛋白磷酸化-去磷酸化,分别由激酶和磷酸酶进行,是控制几乎所有信号过程的主要调控开关。到目前为止,激酶仍然是驱动信号变化的功能反应的核心。然而,最近,蛋白质磷酸酶的抵消作用已经得到了很大的认识,不仅在建立各种信号事件的持续时间和水平,而且在人类疾病的出现。

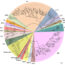
图1所示。构建人类蛋白磷酸酶相互作用之谜。该图以研究最充分的磷酸酶,蛋白磷酸酶2A (PP2A)的形式说明了人类蛋白磷酸酶。PP2A由结构A亚基和催化C亚基以及调节B亚基组成。当PP2A催化C亚基与A和B亚基结合时,产生了几种具有不同活性和底物特异性的蛋白质亚型,即全酶。
人类已经发现了大约140种蛋白磷酸酶,它们分别是磷酸化丝氨酸(pS)、-苏氨酸(pT)和-酪氨酸(pY)残基,在结构上可以划分为三个主要家族:磷酸蛋白磷酸酶家族(PPP)、蛋白磷酸酶金属依赖性家族(PPM)和蛋白酪氨酸家族(PTP)。与其他细胞酶和信号蛋白一样,磷酸酶也具有多蛋白复合物的功能(通过蛋白-蛋白相互作用稳定),在过去几年中,已经开发了一个重要的知识库,以更好地了解它们的进化,多聚体组装,底物识别机制和时空调节(图1)。尽管取得了进展,但我们仍然缺乏关于磷酸酶-底物关系的重要信息。微调磷酸酶复合体活性,为磷酸酶信息网络(磷酸酶相互作用组)奠定基础。
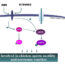
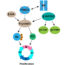
在我们的研究中,我们旨在确定人类蛋白磷酸酶复合物(PPP, PPM和PTP家族)的蛋白质组水平决定因素,并破译其复合物组成的活性依赖的动态变化,主要归因于蛋白质相互作用重塑。因此,我们采用亲和纯化-质谱(AP-MS)为基础的无标记系统方法来全球搜索和量化蛋白磷酸酶复合物的特征。从这一全面的表征(54种催化磷酸酶和12种调节因子)中,我们发现了许多新的磷酸酶相互作用,特别是对于缺乏代表性的磷酸酶家族成员(PPM和PTP),与各种细胞蛋白(相互作用物)。有趣的是,对这些蛋白质的深入分析解释了各种磷酸酶复合物之间的相互关系,这些复合物具有不同磷酸酶家族的独特和不重叠的生物学功能,这当然违背了磷酸酶作用的混杂和冗余的概念。通过比较,我们的数据中PTP家族磷酸酶相互作用物与细胞外区域或膜结合囊泡的绝对关联,显然强调了它们在细胞表面信号传导中的特定作用。此外,这些相互作用蛋白所显示的不同结构域和基序(HEAT、TCP1和WD40等)也扩大了我们对磷酸酶复合物的组织多样性和生化差异的看法。我们的磷酸酶相互作用组研究的另一个值得注意的方面是磷酸酶与许多癌症相关蛋白(cap)的网络。磷酸酶与特定癌症类型(脑肿瘤和白血病)的潜在相关联系不仅表明了磷酸酶在维持细胞内平衡中的作用,而且为开发磷酸酶特异性治疗方法提供了可能的新途径。
我们利用强效磷酸酶抑制剂(PP1和PP2A)冈田酸(OA)进一步推导了磷酸酶复合物组装的定性和定量动力学。有趣的是,尽管PP1和PP2A磷酸酶的活性位点高度保守,但PPP家族成员相互作用谱中基于抑制剂的结构-活性调节(以相对蛋白丰度(标签费MS1定量)的差异来衡量)在PP1和PP2A磷酸酶中更为明显。例如,复合PP2A复合物(一个催化亚基和五个调节亚基)的几个亚成分(纹状蛋白、整合子和tcp1环蛋白)的丰度在OA反应中降低了约3倍,这表明在其酶核心周围蛋白质相互作用的明显重新定向。此外,蛋白质组学检查鉴定了位点特异性磷酸化变化,这不仅解释了oa诱导的结构改变,而且提供了对磷酸酶底物组装或识别和活性因素的见解。
总之,人类蛋白磷酸酶的全局分析使我们能够更完整地了解磷酸酶复合物的组装和活性调节机制,突出了它们在细胞生命中不可或缺的贡献。
Leena Yadav, Markku Varjosalo
赫尔辛基大学生物技术研究所,芬兰赫尔辛基
出版
人蛋白磷酸酶相互作用和动力学的系统分析。
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明
Cell system . 2017年4月26日









留言回复
你一定是登录发表评论。