硒如何与蛋白质结合:硒半胱氨酸“重编码”的结构观点
硒是人体健康所必需的微量营养素。它作为一种特殊的氨基酸存在于蛋白质中,硒代半胱氨酸,也就是所谓的21圣氨基酸。硒代半胱氨酸类似丝氨酸和半胱氨酸,其中硒原子(Se)取代了半胱氨酸的硫原子(S)(图1A)。大多数蛋白质只由20种典型氨基酸组成,很少有蛋白质除了它们之外还有硒代半胱氨酸。实际上,在约2.2万种人体蛋白质中,只有25种含有硒半胱氨酸。虽然含硒半胱氨酸的蛋白质(硒蛋白)很少见,但它们对大脑和睾丸的生成至关重要。此外,硒代半胱氨酸在细菌、古生菌和真核生物这三个生命领域的许多生物中都有应用。
蛋白质是串联排列的氨基酸链,长度从几十到几千不等。每种蛋白质的氨基酸序列信息编码在基因组DNA中相应的基因中。基因被转录为信使rna (mrna),由核糖体翻译成蛋白质。mRNA也是一条串联排列的核苷酸长链,尽管它只由a、U、G和c四种类型的核苷酸组成。因此,称为密码子的三联体核苷酸被翻译成一个氨基酸。共有64个密码子,除UAA、UAG和UGA密码子编码停止信号外,每个密码子编码一个对应的氨基酸。硒代半胱氨酸由终止密码子之一的UGA密码子编码。硒蛋白的信使rna有一个特殊的序列se雷诺cysteine -我插入年代序列(SECIS),位于UGA密码子的下游,响应SECIS被“重新编码”为硒代半胱氨酸。
在翻译过程中,典型氨基酸在转运RNA (tRNA)和延伸因子Tu (EF-Tu)两种因子的帮助下被转运到核糖体。tRNA是一种与氨基酸共价结合的适配分子,EF-Tu将氨基酸连接的tRNA (aa-tRNA)携带到核糖体。每个典型氨基酸都有相应的tRNA种类,而EF-Tu携带所有典型的aa-tRNA。硒代半胱氨酸是由连接到其tRNA (tRNA)的丝氨酸合成的证券交易委员会),硒代半胱氨酸特异性延伸因子SelB,而不是EF-Tu,携带硒代半胱氨酸连接的tRNA证券交易委员会(Sec-tRNA证券交易委员会)到核糖体(图1B)。与EF-Tu不同,SelB也与mRNA相互作用以识别SECIS。
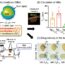
我们通过x射线晶体学在原子分辨率下确定了细菌SelB的三维结构。SelB具有3个ef - tu样结构域(D1-3)和4个翼状螺旋结构域(WHD1-4)(图1C)。ef - tu样结构域与Sec-tRNA结合证券交易委员会而翼状螺旋结构域则与mRNA中的SECIS结合。
SelB与游离半胱氨酸共结晶,游离半胱氨酸模拟硒代半胱氨酸。在Sec- trna的硒代半胱氨酸(Sec)部分的结合袋内观察到半胱氨酸证券交易委员会SelB(图2A)。这个sec结合袋比EF-Tu的相应部位更小,更暴露。根据结合的半胱氨酸,Sec-tRNA证券交易委员会以SelB为模型来可视化它们的相互作用(图2B)。Sec部分的硒醇基团与SelB的精氨酸残基形成离子相互作用,而tRNA的长臂形成离子相互作用证券交易委员会与SelB的D3相互作用(图2B)。这些相互作用实现了Sec-tRNA的特异性证券交易委员会,因为SelB只携带Sec-tRNA证券交易委员会并且不与其他aa- trna结合。
我们还建立了SelB和Sec-tRNA模型证券交易委员会与核糖体结合,在那里Sec-tRNA证券交易委员会容纳核糖体的aa-tRNA结合位点(A位点),而SECIS位于mRNA入口通道的前面(图2C)。SelB桥接Sec-tRNA证券交易委员会和SECIS通过与核糖体相互作用,表明Sec结合机制的结构基础。
出版
全长细菌硒半胱氨酸特异性延伸因子SelB的晶体结构。
伊藤Y,关健S,横山S。
《核酸》2015年10月15日














留言回复
你一定是登录发表评论。