随波逐流:研究t细胞到炎症部位的运动
炎症是免疫系统的保护性反应,有助于清除入侵的感染因子和修复组织损伤。它涉及到白血球(白细胞)从血液中穿过血管壁的细胞(内皮细胞)进入受影响的组织。这些步骤都是严格控制的,以防止不必要的组织损伤。我们的综述集中在一种特殊类型的白细胞,称为t细胞,以及它们进入感染或受伤组织必须通过的安全检查点。我们还强调了在慢性炎症性疾病和衰老中如何绕过这些检查点,导致t细胞在组织中不受控制的积累和过度的组织损伤。

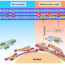
图1所示。T细胞炎症级联募集(改编自Chimen et al., 2017)。
这种级联涉及一系列精心调节的步骤,由细胞表型和功能的顺序变化驱动。流经血液的T细胞被内皮粘附分子(选择素)从血流中短暂捕获(1),这些分子以高亲和力与细胞结合,但很快被释放。这使得T细胞减缓并沿着血管表面“滚动”(2)。定位特定的归巢分子,如趋化因子和脂质介质,传达炎症威胁的特定位置和性质。这些信号的结合通过引起构象变化,从而产生高度粘附的表型(3),从而“激活”T细胞整合素,这导致细胞在内皮细胞上停止并变平(4)。最后,T细胞也获得了结合内皮细胞连接分子的能力,允许在称为转运的过程中穿过血管壁进入组织。这可以发生在内皮细胞之间(细胞旁)或直接通过内皮细胞(细胞外)(5)。
内皮细胞报告其局部环境的变化。在健康组织中,它们处于静止状态,对血液中循环的t细胞“不可见”。炎症刺激,如感染,标志着局部内皮从静息状态转变为活跃状态(图1)。激活的内皮现在表达与t细胞结合并帮助它们进入组织所需的蛋白质(捕获和粘附受体)。这一连串的事件开始于t细胞被内皮细胞通过捕获受体(选择素)从血液中捕获。这种最初的结合是不稳定的,t细胞被流动的血液的力量推着沿着内皮表面。滚动的t细胞接收来自内皮的信号(趋化因子或脂质),这些信号激活它们牢固的粘附受体(整合素),导致t细胞停止滚动,并改变形状——与内皮对抗变平。最后,被阻滞的t细胞穿过血管壁,通过内皮连接,并跟随受损组织产生的定向信号(趋化因子)继续在组织中移动。在组织内,t细胞指示炎症反应促进威胁的清除和愈合,然后通过淋巴内皮离开组织来解决反应。

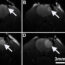
图2所示。实时观察细胞运动。
这些图像是使用共聚焦活体显微镜拍摄的,可以实时观察活体组织中的细胞。它们描绘了一种被称为单核细胞的免疫细胞的迁移,这种免疫细胞使用一种被称为CFSE的细胞染色溶液(绿色显示)进行了荧光标记。细胞正在穿过小鼠腹股沟肌的小静脉,该肌肉被一种称为转化生长因子-β1 (TGF-β1)的细胞因子刺激(图片由M. Chimen提供,2017)。
虽然主级联已经得到了很好的研究,但最近的证据已经确定了几个新的安全检查点,这些检查点在上面和图1中描述的基本级联之上施加了额外的监管级别。这方面的一个例子是脂联素- pepitem途径,它负性地调节t细胞在炎症血管中的迁移。作为对脂联素的反应,与内皮结合的b细胞释放PEPITEM(肽抑制剂的跨内皮迁移),这反过来导致内皮产生和释放脂质,鞘氨醇-1-磷酸(S1P)。S1P关闭了t细胞上的一些整合素,阻断了它们在内皮细胞中迁移的能力。这一途径在1型糖尿病、类风湿性关节炎和老年人中被证明是失调的,导致t细胞不适当地流入受影响的组织。
同样,组织常驻细胞(基质细胞)与邻近的内皮细胞交流,抑制t细胞进入急性炎症组织。有趣的是,从慢性炎症性疾病患者身上提取的基质细胞失去了这种保护性反应,错误地授权内皮细胞结合t细胞,促进它们在病变组织中的有害积累。这似乎导致某些细胞因子(如IL-6, TGFβ)的生物活性从抗炎作用转变为促炎作用,例如在类风湿性关节炎中。
显微镜技术的最新进展和荧光蛋白的使用意味着我们现在能够更好地在活体组织中实时更详细地探索这些动态过程(图2)。其他进展包括研究流动条件下细胞迁移的各个组成部分,这使我们能够模拟血液的生理流动,这是使用早期的分析方法无法做到的。这种对炎症期间控制白细胞进入组织的分子机制的无与伦比的洞察,将揭示潜在的新疗法,针对与慢性炎症疾病有关的不同水平的这种招募级联。
克莱尔·s·马丁1,祝你生日快乐2,Myriam Chimen2,海伦·m·麦格特里克1
1风湿病研究小组,官方manbetx手机版
英国风湿性关节炎研究官方manbetx手机版中心,
英国伯明翰大学炎症与衰老研究所,伯明翰,b152wb
2英国伯明翰大学心血管科学研究所,伯明翰b152tt
出版
导论:T细胞在炎症和免疫中的转运。
齐曼M, Apta BH, Mcgettrick HM
方法《Mol Biol》,2017










留言回复
你一定是登录发表评论。