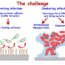
利用癌症固有的弱点来战胜癌症
癌症的治疗是一个矛盾而复杂的过程;用来杀死癌细胞的药物对你的健康组织也是有毒的。然而,肿瘤的不同生理机能提供了一种通过使用定制的药物载体更安全、更有效地递送药物的途径。刺激反应纳米材料已经成为抗癌药物的可编程传递系统,以使它们摆脱细胞毒性的限制。刺激反应材料可以是外部激活的,也可以是被动的自我触发的。我们专注于后者,它利用肿瘤等疾病的异常组织,其中组织有渗漏的血管,某些生物标志物的过度生产,肿瘤环境中温度升高和局部酸性细胞外pH值;所有可以被利用来触发药物释放的因素。在本研究中,我们针对肿瘤的平均pH值低于正常组织,选择性释放抗癌药物。

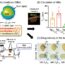
图1所示。通过模拟癌症肿瘤中较低的pH值,我们能够改变脂质分子的形状,因为分子极性“头部”上的胺基团发生了质子化。2.这导致药物传递基质的纳米结构发生变化,从H2(缓释)到v2(快速释放),如小角度x射线散射所示。3 a。因此,在癌变状态下(pH值5.5),比在健康状态下(pH值7.4),更多的抗癌药物阿霉素从凝胶中释放出来。3 b。这导致在pH值为5.5(肿瘤状态)时人类结肠癌细胞死亡比pH值为7.4(健康状态)时增加。
溶致液晶为可触发药物递送提供了完美的纳米结构基质。这些系统由两亲性脂质分子组成,这些分子在水环境中自组装形成具有复杂三维纳米结构的凝胶,能够控制不同性质和大小的药物的释放。这些结构的几何形状和对称性决定了药物的释放速度,而释放速度可以通过控制分子的自组装来精确地改变。这是通过操纵脂质形状和脂质堆积来控制的,通过改变环境因素(如ph)来实现。形成的最有利的结构是双连续立方结构(v2)和逆六方相(H2).设想v2两个纳米大小的水管永远不会相遇,扭曲成一个3D图案;药物从这种纳米结构中迅速释放出来。想想H2长而封闭的纳米管呈六边形排列;药物从这种纳米结构中缓慢释放。
我们已经开发出一种ph值敏感的纳米结构凝胶,它有望成为战胜癌症的药物输送系统。通过将少量新合成的弱碱吡啶-4-甲基亚油酸酯(PML)加入中性脂质单油酸,使该体系的pH响应。两亲性PML被明确设计为电离,在低浓度的pH变化下,它可以通过PML头基的质子化来操纵凝胶的纳米结构(图P1)。在正常pH下,PML是中性的,它促进封闭H的形成2纳米结构。它在低pH(≤5.5)下的电离导致分子头部膨胀,从而切换到开v2纳米结构(图P2)。
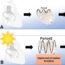
v的不同本征输运速率2和H2在两种不同的pH值(pH 5.5和7.4)下模拟癌症和健康状况。在癌症条件下,凝胶内抗癌药物阿霉素的释放速度比正常组织快10倍(图P3A)。这一特征随后被用于人类结肠癌细胞的细胞培养研究(图P3B)。在凝胶存在的情况下,癌细胞仍然可以存活,更重要的是,当纳米结构为H时,在pH为7.4的环境下,癌细胞的存活率是原来的三倍2然后换成v2由于pH感应开关(图3B中的红色矩形),pH值为5.5。
因此,本研究表明,脂基溶性液晶基质可以改变其对称性,以响应pH从7.4到5.5的变化,从而实现阿霉素的pH控制释放行为。从概念的角度来看,这些专门设计的ph反应凝胶可以利用肿瘤组织中遇到的最酸性条件作为肿瘤靶向递送系统。这种给药方法有可能将现代癌症化疗提升到一个新的水平。
Raffaele Mezzenga教授
卫生科学与技术系,苏黎世,瑞士
出版
ph响应性溶性液晶及其在癌症治疗中的潜在治疗作用。
李建平,方伟,张建军
化学通讯(Camb)。2015年4月18日










留言回复
你一定是登录发表评论。