多泛素链的杂色世界
蛋白质与生物共同经历出生、生命和死亡。当DNA中包含的信息被翻译成氨基酸链并在自然环境(即细胞内部、膜或生物液体)中生活时,它们就“出生”了。但最终,蛋白质需要被处理掉,以避免它们的“老化”可能导致功能失调。大自然发现了一种“聪明”的方法来标记蛋白质的死亡,这种方法通常(但并不总是)是通过一种叫做蛋白酶体的分子机器将蛋白质切割成单个氨基酸来实现的。“红字”以泛素的形式出现。这是一种小的球状蛋白,“无处不在”地存在于真核生物中。泛素参与了几种不同的细胞调节机制,这要归功于它通过形成一种称为共价键的稳定连接来结合其他蛋白质的能力。这是在泛素的最后一个氨基酸(甘氨酸76)和目标蛋白的赖氨酸之间形成的。由于一种叫做泛素连接酶的特殊酶的作用,形成稳定的键是可能的。去泛素化酶(DUBs)的功能是破坏泛素和另一种蛋白质之间的共价键。 Ubiquitin ligases and DUBs thus finely regulate ubiquitin signaling.
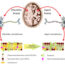
由于泛素有7种赖氨酸(以及初始的蛋氨酸,在特定条件下也可以形成链)可以与另一种泛素分子的甘氨酸76结合,因此它可以形成多泛素链(即由多个泛素分子形成的链)。每条链含有一定数量的泛素亚基(二泛素=2个亚基,三泛素=3个亚基,等等),它们通过共价键连接在一起,就像项链上的珍珠或环上的孩子(图1)。链在连接赖氨酸(或蛋氨酸)的位置上大多数(但不是全部)是均匀的。所有可能的多泛素链(Lys6-、Lys11-、Lys27-、Lys29-、Lys33-、Lys48-、Lys63-和met1链)都存在于人类细胞中,也发现了混合链或支链。每条链似乎都有特定的功能。lys48链是最著名的,它们完成了上述死亡标记功能。当目标蛋白与Lys48多泛素链连接时,该蛋白被蛋白酶体招募并降解。其他联系类型的功能是多种多样的,在某些情况下不太清楚,但预期这种可能的联系的丰富性提供了发挥不同作用的巨大机会。
阐明多泛素链作用的一种方法是了解它们的空间三维结构(图2)。这是因为结构通过影响蛋白质与其他伙伴相互作用的能力来定义功能。几位研究人员已经官方manbetx手机版解决了这个问题,他们在实验室里制造了这些链,并用各种技术解决了它们的结构。从这些研究中我们了解到,多泛素链的结构受泛素表面的连接类型和疏水区域相互作用的可能性的影响。例如,Met1-和lys63链具有扩展的结构,可以将疏水表面暴露给蛋白质伙伴进行相互作用。相反,lys48链采用紧凑的封闭结构,隐藏了与开放结构平衡的疏水界面。
多泛素链的另一个重要特征是它们能够动态改变其结构以适应其伴侣的结构以优化相互作用。通常,多个链组件与伙伴相互作用,从而有利于识别和增加亲和力。
我们已经回顾了如此小的蛋白质如何提供复杂的链结构和相互作用模式,使泛素参与各种细胞过程,如蛋白质降解,基因表达控制,细胞周期调节,DNA修复,信号转导,蛋白激酶激活和内吞作用。
Caterina阿尔法诺1我是瑟琳娜·法吉亚诺2和安娜莉莎帕斯托雷1
1英国伦敦国王学院临床与基础神经科学系
2意大利帕尔马大学药学系
出版
多泛素的球形和链状结构。
张国强,张国强。
趋势生物化学科学2016年2月15日













留言回复
你一定是登录发表评论。