新型肌肉再生仿生材料
骨骼肌的形成源于分子和细胞变化的协调序列,最终导致大而多核的收缩纤维的表达,其特征是横纹肌原纤维的高度有序组装。为了形成收缩纤维,发育中的细胞激活了一个基因表达程序,该程序负责在成肌细胞分化和融合过程中观察到的细胞表型的显著改变。
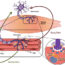
在组织再生过程中也会发生类似的一系列事件:骨骼肌再生是组织在使用、损伤或疾病后修复的过程。当肌肉受损时,再生反应会随着驻留的干细胞/祖细胞,即卫星细胞的激活而启动。然而,虽然骨骼肌可以在一定程度上自我修复,但一旦由于创伤、先天性缺陷、手术或去神经支配而丢失,它就不能再生大量的组织。在这种情况下,组织工程有望替代受损肌肉和治疗肌肉疾病。
仿生学是一种基于从自然发生的系统中获得灵感的方法,现在被认为是设计和制造用于再生医学和组织修复的结构的一种有价值和有前途的策略。近年来,蛋白质工程为设计能够在分子水平上诱导生物系统特异性反应的高级功能生物材料开辟了新的视角。新一代这样的智能化合物,人类弹性蛋白样多肽(帮助),是在我们的实验室开发的。它们由重组人工多肽组成,这些多肽基于人体弹性蛋白中发现的特定氨基酸序列,弹性蛋白是细胞外基质赋予组织弹性的结构成分。HELP多肽的一个关键特征是其模块化结构,允许对蛋白质进行剪裁:选择生物活性结构域与弹性蛋白样主干的融合有望赋予重组蛋白特定功能。
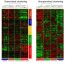
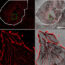
在这项研究中,我们通过在其末端融合IV型胶原蛋白序列合成了HELPc,这是HELP系列中的一种新型多肽,IV型胶原蛋白是一种在基底膜中大量表达的细胞外蛋白。所采用的序列包含两个Arg-Gly-Asp (RGD)动机,即称为“整合素”的细胞粘附受体的识别序列,预计将改变细胞粘附特性和肌肉细胞分化的后续步骤。我们使用HELPc以及同一家族的两个多肽变体(命名为HELP和HELP1)作为C2C12成肌细胞的粘附底物,C2C12成肌细胞广泛用于分化研究,正如它们所概括的那样。在体外大多数分子事件导致可收缩肌纤维的发育。细胞粘附在所有的help上,在那里它们呈现出依赖于多肽序列的形态和细胞结构。黏附于help在不同程度上刺激细胞增殖、分化标记的表达和排列纤维融合成多核肌管。不同的粘附底物显著改变了肌管硬度和肌肉收缩机制的成熟。最后,当用人类淋巴细胞进行测试时,help未能刺激炎症反应的证据令人鼓舞,并将刺激未来的研究,旨在测试在组织工程策略中使用help多肽的可能性。官方manbetx手机版
这些仿生大分子的简化结构同意一种简化的方法,直接将结构和功能联系起来,从而允许因果关系的分子机制负责细胞功能的粘附依赖性调节。此外,与细胞外基质提取物相比,这些多肽的重组合成具有无可置疑的优势,因为它可以无限地生产具有高度可重复性的材料。
综上所述,我们的研究结果表明HELP多肽是研究骨骼肌生物学中结构-功能关系的有前途的工具,是骨骼肌再生的一种合适的生物材料。
Paola D 'Andrea, Antonella Bandiera
的里雅斯特大学生命科学系
出版
重组人弹性蛋白样蛋白诱导的体外肌生成。
D 'Andrea P, Scaini D, Severino LU, Borelli V, Passamonti S, Lorenzon P, Bandiera A
生物材料。2015年10月











留言回复
你一定是登录发表评论。