修饰包膜(Env)蛋白的病毒样颗粒(VLP)的免疫原性
HIV利用一种特殊的策略来逃避人类感染过程中的免疫系统,这是基于包膜蛋白的特征。在病毒颗粒表面形成刺突的HIV Env糖蛋白是两个亚基的复合体:表面gp120,介导病毒与特定细胞表面受体的结合,以及gp41-表面-跨膜-细胞质亚基,促进膜融合(图1a)。作为免疫系统主要靶点的天然Env被认为以亚稳态存在于病毒颗粒表面。免疫系统不能产生针对这些Env蛋白的保护性抗体,但确实可以诱导针对HIV的非中和抗体。膜融合的特异性调控在病毒进入等生物学功能中具有重要意义。Env蛋白的构象变化可以通过受体结合或gp41细胞质结构域(CT)的内向外信号触发,从而使其对免疫系统敏感。不幸的是,由受体结合引发的Env蛋白的构象变化发生在细胞内的核内体中(图1a)。基因修饰的CT结构域可以影响gp41在细胞表面的外部结构域的构象,也可能增强gp120中受体结合片段的暴露(图1B)。
VLPs被组装成非传染性逆转录病毒样颗粒,其形态与自然发生的病毒粒子非常相似,它们的生产只需要Gag多蛋白。免疫系统可以有效地识别颗粒形式的抗原,这种抗原模仿了天然病毒粒子。VLP的一个重要特征是它含有具有天然构象的三聚体Env,并使Env尖峰稳定,避免免疫误导和诱导非中和抗体反应。利用酵母GCN4转录因子的亮氨酸拉链三聚化序列,三聚体形式的靶蛋白可以稳定表达。天然包膜蛋白被低水平地掺入VLP。

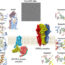
图2所示。修饰HIV-1 Env三聚体以生产更有效的VLP疫苗。(A) HIV-1 Env三聚体由三个gp120表面亚基和三个gp41跨膜亚基组成。Gp41含有一个22个氨基酸的跨膜结构域(TMS)和一个全长150-200个氨基酸的细胞质结构域(CT) (B)修饰的Env蛋白含有一个35aa的TMS结构域(TMS-35)和来自MMTV Env的CT,显示出与VLP的高水平结合。(C)修饰的Env蛋白含有来自MMTV Env的更短的22aa版本的TMS (TMS-22),并在СТ中含有GCN4三聚体序列,预计会提高三聚体的稳定性,在免疫动物中诱导广泛反应性中和抗体反应。保护性抗体为红色;非中和抗体用蓝色表示。
与含有天然Env HIV-1糖蛋白的VLP相比,含有Env HIV-1外部部分的修饰蛋白暴露于VLP和小鼠乳腺肿瘤病毒MMTV的另一种Env蛋白衍生的跨膜跨越区(图2a,B,C),在豚鼠中显示出与VLP结合水平显著增加,并诱导强烈的免疫反应(图2b,C)。C)。含有高Env含量和CT三聚化序列的VLPs免疫的动物具有更高的中和活性和抗体的亲和力(图2 C)。含有不同Env的免疫提供了刺激特定于保守表位的反应的机会,进一步增强了这些免疫反应。特别是,含有修饰Env的VLPs被发现是一种有效的HIV-1疫苗抗原。
Andrei Vzorov博士
微生物与免疫学系,
美国亚特兰大埃默里大学
伊万诺夫斯基病毒学研究所,加马列亚联邦研究中心官方manbetx手机版
流行病学和微生物学,莫斯科,俄罗斯
出版
修饰HIV-1 Env细胞质尾部对VLP疫苗免疫原性的影响
王Vzorov, L,陈J,王,伴随矩阵RW光碟
病毒学。2016年2月











留言回复
你一定是登录发表评论。