跟我一样吗?一个关于酶的招募和激活的故事
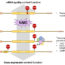
蛋白质合成是一个能量昂贵的细胞过程,部分原因是核糖体组装和基因特异性信使RNA (mRNA)产生的代谢需求。因此,通过蛋白质翻译途径的生物合成通量受到严格调控,而翻译失调与从智力迟钝到癌症等疾病有关。生物体已经进化出多种手段来调节核糖体的生物发生、活性和周转。在面包酵母中,Prp43 DExD/H-box RNA解旋酶是核糖体RNA (rRNA)和mRNA成熟所必需的,因此整合了蛋白质合成所需的两种不同的RNA输入。Prp43活性的丧失抑制了25和18S rRNA加工的多个步骤,并损害了从pre-mRNA中去除内含子的效率和保真度。三个蛋白,每一个都带有一个松散保守的富含甘氨酸的G-patch基序,在rRNA成熟(Sqs1, Pxr1)和pre-mRNA剪接(Spp382)中对Prp43的功能至关重要。G-patch基序是Prp43的酶促激活所必需的,至少对于Spp382来说,似乎足以刺激体外Prp43核酸解绕(即解旋酶)活性。鉴于这些观察结果,Spp382、Sqs1和Pxr1的作用似乎相似,共同的G-patch结构域有助于促进Prp43的激活,并具有指导rRNA或pre-mRNA通路特异性关联的独特特征。

图1所示。调控Prp43解旋酶活性。Prp43解旋酶刺激80+亚基剪接体和200+亚基核糖体前RNA加工机制的关键构象变化。另外三种区域G-patch蛋白Spp382、Sqs1和Pxr1促进Prp43在细胞内的物理和功能分区,从而促进rRNA和mRNA加工途径的整合。
通过遗传学和生化研究来验证G-patch功能的假设。结果表明,虽然G-patch足以与Prp43相互作用,但三种G-patch肽在Prp43的表观亲和力以及促进Spp382在pre-mRNA剪接中的活性和Pxr1在rRNA加工中的活性方面存在很大差异。G-patch对Prp43相互作用的依赖性与G-patch-Prp43酵母双杂交(蛋白结合)反应的强度之间存在相关性,其中Spp382 G-patch相互作用最好,而Spp382-Prp43相互作用完全依赖G-patch。相比之下,Pxr1 G-patch与Prp43的相互作用较差,Pxr1-Prp43的相互作用基本上与G-patch无关。Spp382和Pxr1的G-patch基序在结构域交换实验中被证明是不相容的,而Sqs1 G-patch基序在两种嵌合环境中都是可以接受的妥协。令人惊讶的是,Pxr1 G-patch结构域H55P内的单个氨基酸变化足以恢复Spp382-Pxr1 (G-patch)嵌合体的大部分剪接活性,而不会明显增强Prp43的相互作用。与之前在Sqs1中看到的类似,Pxr1 G-patch结构域外的Pxr1序列稳定了Prp43的相互作用,但矛盾的是,这些序列对于rRNA加工中依赖Pxr1的Prp43活性是必不可少的。
大多数真核生物含有24个或更多的DExD/H-box RNA解旋酶,这些酶在RNA的合成到衰变的生物化学过程中起作用。这些必须进行调节,以防止非生产性ATP消耗和早熟的生物活性。然而,人们对它们的交易监管机构的性质和功能知之甚少。我们的工作和其他人的相关观察结果支持Spp382、Sqs1和Pxr1蛋白通过复杂的相互作用结合Prp43以刺激其解旋酶功能的观点。这些数据反对G-patch基序作为简单的可互换结构域,并提出了每个G-patch蛋白的独特特征如何在RNA加工中贡献上下文特异性信息的问题。我们认为,真核生物基因表达的多个步骤可能可以通过对DExD/H-box蛋白辅因子的遗传或药理学操作进行实验操作。
布莱恩·c·雷蒙德
美国列克星敦肯塔基大学生物系
出版
酿酒酵母中pre-mRNA剪接和核糖体RNA成熟所需的Prp43 RNA解旋酶调节因子G-patch结构域的有限可移植性。
Banerjee D, McDaniel PM, Rymond BC
遗传学。2015年5月











留言回复
你一定是登录发表评论。