霍乱噬菌体中CRISPR-Cas系统的新多样性
细菌与噬菌体的相互作用导致了许多噬菌体抗性机制的进化,而噬菌体是细菌生存的敌对病毒。CRISPR-Cas(聚集规律地穿插短回文重复crispr相关蛋白)就是这样一种细菌防御系统。由核酸酶基因和非编码RNA元件基因组成的CRISPR-Cas系统可以通过切割特定位点的DNA来破坏入侵的噬菌体DNA。细菌DNA中的CRISPR阵列由短的直接重复核苷酸序列组成,由不同的短间隔序列分隔。间隔物最初是从噬菌体与细菌相遇时产生的噬菌体DNA片段中提取的。为了发挥作用,非编码CRISPR阵列在直接重复序列中被转录和切割成含有单个间隔序列的短crrna。crRNA引导Cas核酸酶到达与crRNA间隔序列互补的靶位点,Cas核酸酶降解入侵噬菌体基因组。

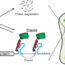
图1所示。噬菌体JSF5、JSF6、JSF13和JSF17所携带的CRISPR-Cas系统结构,显示间隔物的多样性和排列方式。重复序列(28bp)和间隔序列(32bp)分别用绿色菱形和红色矩形表示。一个富含at的先导序列位于每个CRISPR位点(黑色矩形)之前。
在另一种方法中,细菌通过宿主称为噬菌体诱导染色体岛(PICI)的染色体岛来防御噬菌体感染。在噬菌体感染后从染色体上切除,这个岛循环、复制并干扰噬菌体的繁殖。霍乱弧菌引起霍乱流行的菌株已被发现携带可抵抗强毒噬菌体的pi样元素(PLE),如果这些细菌不携带PLE,通常会被噬菌体杀死。目前流行的El - Tor生物型菌株霍乱弧菌不携带CRISPR-Cas系统,因此PLE介导的噬菌体复制抑制在这些菌株中是突出的。值得注意的是,霍乱弧菌特定的噬菌体已被证明携带CRISPR-Cas系统,该系统可以灭活dna中ple的功能诉霍乱埃尔托菌株。这些噬菌体中的CRISPR阵列携带的间隔序列与菌株携带的18kb PLE的不同区域完全相同。
在我们最近的研究中(纳赛尔)等. ., 2017),我们在孟加拉国的自然环境中发现了噬菌体编码CRISPR-Cas系统的进化特征,那里经常发生霍乱疫情,据报道,由于噬菌体捕食病原体,疫情崩溃。利用全基因组测序,我们分析了噬菌体和霍乱弧菌在2001年至2015年的季节性霍乱流行期间进行分离,以监测PLE分布和噬菌体编码CRISPR-Cas系统的变化。鉴定出5种不同但相关的携带CRISPR-Cas系统的噬菌体,以及可能的CRISPR-Cas阴性祖噬菌体。此外,发现噬菌体中的CRISPR阵列通过获取新的间隔物而进化,这些间隔物针对的是由噬菌体携带的不同区域的dna片段霍乱弧菌菌株(图1),使噬菌体能够在PLE阳性菌株上高效生长。具有更多这些间隔序列的噬菌体在感染霍乱细菌方面也更有效,这表明获得多个CRISPR间隔序列增加了病毒逃避细菌防御的能力(图2)。
我们的研究结果表明,涉及噬菌体抗性遗传决定因素的持续军备竞赛霍乱弧菌和噬菌体编码的CRISPR-Cas系统,可能是由于它们在季节性霍乱流行期间加强了相互作用。因此,这项研究代表了一个有效的自然实验,以了解噬菌体编码的CRISPR/Cas系统如何随着时间的推移而进化。这个系统不同于大多数已知的CRISPR-Cas系统,因为它不是在细菌中发现的,而是在攻击细菌的病毒中发现的。

图2所示。联合进化的霍乱弧菌O1及其噬菌体在PLE与CRISPR-Cas介导的军备竞赛中的作用。热图显示了按时间顺序收集的易感性霍乱弧菌2001年至2015年在孟加拉国季节性霍乱流行期间分离出的O1到8种不同的噬菌体。用星号表示的噬菌体对CRISPR-Cas系统呈阳性。
这项工作可能会导致设计携带最佳CRISPR-Cas系统的噬菌体,以逃避细菌对病毒的防御,从而更有效地杀死它们。这一知识对于开发潜在的噬菌体介导干预策略以控制霍乱或其他细菌感染也具有重要意义。
Shah M Faruque
孟加拉国独立大学生命科学学院,
巴申哈拉,达卡1229,孟加拉国
出版
孟加拉国霍乱弧菌流行菌株噬菌体中CRISPR-Cas系统的分析。
Naser IB, Hoque MM, Nahid MA, Tareq TM, Rocky MK, Faruque SM
2017年11月1日












留言回复
你一定是登录发表评论。