EphA2在巨噬细胞/单核细胞有效移植脾中的作用
脾由白髓和红髓组成。前者又分为t细胞区和b细胞滤泡,后者又分为脾窦和脐部。脾脏对白髓中的血源性抗原产生免疫反应,并在红髓中过滤血液。最近,我们知道在囊下红髓的索中有比血液循环中更多的单核细胞,这些单核细胞在组织损伤时被动员到炎症组织中。因此,单核细胞迁移和迁出系统可能在脾脏中起作用。脾脏拥有一个独特的血管系统,对这些功能是不可或缺的。在啮齿类动物中,一条被淋巴组织包裹的中心动脉穿过白髓的t细胞区,并延伸出分支,这些分支要么进入白髓的b细胞滤泡,要么终止于白髓和红髓之间边缘区的边缘窦。

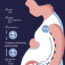
图1所示。示意图显示(1)ephrin-A1、CXCL12和ICAM1的表达,(2)J774.1(红色)和EphA2∆C-J774.1(绿色)细胞在脾脏的分布。将等量的J774.1细胞和EphA2∆c -J774.1细胞分别用Far Red和CSFE标记,静脉注射到BALB/c小鼠体内,BALB/c小鼠在细胞注射前一天腹腔注射氯钠包封阴离子脂质体。
随后,动脉越过边缘区进入脾索,并延伸出末端小动脉的分支,其末端进入脾索网状,形成开放循环。白髓的组织参与淋巴细胞的迁移和沉积,趋化因子和趋化因子受体是t细胞区和b细胞滤泡形成的必要分子,而红髓的组织尚不清楚,特别是关于单核细胞和巨噬细胞的迁移和/或沉积。
我们之前建立了一个J774.1单核/巨噬细胞亚线,表达缺乏激酶结构域的截断EphA2构建体(EphA2∆C-J774.1),并证明在ephrin-A1刺激后,内源性EphA2通过与整合素和整合素配体(如ICAM1)的相互作用促进细胞粘附,并且截断的EphA2增强了粘附并与整合素/整合素配体复合物相关。基于这些发现,我们假设EphA/ephrin-A系统,特别是EphA2/ephrin-A1,调节单核细胞/巨噬细胞的跨内皮迁移/组织浸润,因为ephrin-A1被广泛认为在炎症血管中上调。
为了评估这一假设是否适用于脾脏,我们筛选了ephrin-A1、ICAM1和CXCL12的表达,并重新检查了J774.1亚系的细胞特性。我们发现(1)ephrin-A1在边缘区血管和红髓中表达,并且随着吞噬细胞的减少表达上调;(2)ICAM1在红髓窦内皮细胞和毛细血管内皮细胞、边缘区微血管内皮细胞和红髓成纤维细胞中表达;(3)CXCL12在窦内皮细胞和红髓成纤维细胞中表达(图1)。我们进一步发现CD115、F4/80、和CXCR4在J774.1细胞中表达,可作为单核/巨噬细胞的可用替代品。此外,在ephrin-A1刺激后,截断的EphA2并没有明显干扰内源性EphA2的磷酸化,它可能通过调节整合素的亲和力来增强细胞粘附(Saeki等人,cell Adh Migr, 2014)。因此,通过静脉注射等量的J774.1和不同荧光色标记的亚线细胞,我们确定截断的EphA2显著增强了优先细胞向红髓和边缘区浸润(图1)。

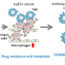
图2所示。相衬图像与荧光图像合并显示Far red标记的J774.1细胞(粉红色或深红色)和csfe标记的EphA2∆C-J774.1细胞(绿色),培养在涂有ephrin-A1-Fc和ICAM1-Fc/ICAM1-Fc条纹的复盖表面。
这一发现表明,截断的EphA2在亚系细胞中的额外表达会导致有效的浸润和/或沉积,可能是因为它增强了细胞粘附,类似于在细胞粘附条纹实验中观察到的结果(图2)。因此,EphA2信号的调节可能有助于组织特异性巨噬细胞和/或单核细胞的有效移植。
小川和成,近田直子
日本大阪府立大学兽医解剖实验室
出版
截断的EphA2可能通过整合素增强细胞粘附,以及单核/巨噬细胞系在小鼠脾脏红髓和边缘区浸润和/或沉积,其中ephrin-A1在脉管系统中显著表达。
近田N,佐木N,西野S,小川K
《组织化学细胞生物学》2017年3月











留言回复
你一定是登录发表评论。