是否有可逆和不可逆的蛋白质聚集?
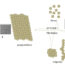
负责蛋白质聚集的蛋白链区域的发现是朊病毒疾病分子机制研究的重要成果,不同的蛋白质病变通过朊病毒机制与病理聚集的形成相关。朊病毒网络反映了细胞中蛋白质组的真实情况,当蛋白质的变化影响到其他蛋白质的结构和功能时。控制蛋白质聚集的能力可能是药物开发武器库中的一个重要工具。许多疾病都伴有淀粉样纤维在不同器官的沉积,这并不奇怪。因此,有必要了解天然蛋白向淀粉样原纤维转化的过程,以阐明该过程中的哪些关键因素决定了蛋白质错误折叠的途径。最近,人们对可逆的交叉b结构的形成机制进行了大量的研究,这种结构具有液体的性质,但也可以形成凝胶状,从而促进rna和rna结合蛋白的保留(图1)。
许多形成应激颗粒所需的rna结合蛋白含有朊病毒样结构域,由于蛋白质-蛋白质相互作用,形成能够快速聚集和解离的动态交叉结构域,这对应激颗粒的正确功能非常重要。为了了解应力颗粒的组装和拆卸机制,有必要了解rna结合蛋白链中哪些区域可以发挥引物的功能,以及低复杂性的无序区域的作用。据推测,rna结合蛋白可能通过朊病毒样结构域的自组装参与了应激颗粒的排列。含有朊病毒样结构域的FET家族蛋白(FUS、EWS和TAF15)是研究朊病毒机制下蛋白质聚集体形成过程的理想模型。它们通过应力颗粒形成原理,在有利条件下通过组装和拆卸机制发挥作用。
无论如何,已经确定rna结合蛋白的紊乱部分专门负责水凝胶的形成和与水凝胶的结合(见图1)。因此,即使去除与rna结合结构域对应的c端区域,蛋白质FUS仍保持其凝胶形成的能力,但当去除与朊病毒样结构域对应的n端紊乱区域时,蛋白质FUS失去了这种能力。fet家族蛋白紊乱区大量重复序列的存在,可以调节和加速应力颗粒和病理聚集体中可逆动态交叉β结构的形成。

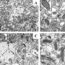
图2所示。用IsUnstruct程序预测带有朊病毒样结构域的rna结合蛋白(TAF15)的有序或无序残基状态。y轴0.5处的连续线是残差无序的阈值线。浅绿色表示朊病毒样结构域。RRM是RNA识别基序。RGG对应的区域富含精氨酸和甘氨酸。锌是锌指图案。
FET家族蛋白质中预测的紊乱区域与朊病毒样结构域和揭示串联不完全重复的其他区域相对应。更重要的是,当一个氨基酸被重复多次时,这些蛋白质的特征是存在同源重复。TAF15在朊病毒样结构域中包含8个不完全串联重复序列,在c端部分包含21-23个串联重复序列(见图2)。这些重复序列在图上可以看到锯齿状。对于更复杂的生物体,重复次数增加:小鼠蛋白在c端部分有19个重复,鸡有4个,鱼有5个。
无论如何,已经确定rna结合蛋白的紊乱部分专门负责水凝胶的形成和与水凝胶的结合(见图1)。因此,即使去除与rna结合结构域对应的c端区域,蛋白质FUS仍保持其凝胶形成的能力,但当去除与朊病毒样结构域对应的n端紊乱区域时,蛋白质FUS失去了这种能力。fet家族蛋白紊乱区大量重复序列的存在,可以调节和加速应力颗粒和病理聚集体中可逆动态交叉β结构的形成
Oxana V. Galzitskaya
俄罗斯科学院蛋白质研究所官方manbetx手机版
出版
FET家族蛋白质的可逆和不可逆聚集:蛋白质链重复序列对其聚集能力的影响
Galzitskaya机汇。
2015年6月22日









留言回复
你一定是登录发表评论。