R15、R16和R17的谱域在结构和力学性能上是否存在差异?
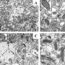
Spectrin是一种细胞骨架蛋白,在维持质膜完整性和细胞骨架结构中起重要作用。它决定了细胞的强度、机械稳定性和变形能力。Spectrin形成由α链和β链组成的反向平行异源二聚体。这种蛋白质具有由重复的杆状单位组成的细长形状。α-spectrin的每个单元(重复或结构域)包含三个α-螺旋,形成具有右旋的简单三螺旋束(图1)。Spectrin重复序列对活细胞的功能很重要。

这里我们只考虑鸡脑α-spectrin的三个已知重复序列:R15、R16和R17的特性。尽管它们的结构相似(α-螺旋的大小、二级结构中残基的比例、螺旋间的角度、稳定性、氢键数),但实验表明,这些结构域具有不同的折叠和展开速率,以及不同的折叠机制。此外,我们已经证明了这些结构域具有不同的机械稳定性。R15的机械稳定性不如R16, R16又不如R17。为了解释这种机械稳定性的差异,我们发现了可以解释这种行为的附加性质。
对氨基酸组成的分析表明,尽管这些结构域具有相同数量的芳香氨基酸残基(每个结构域有10个),但它们在芳香簇中涉及的芳香残基数量不同(图2A)。R15有一个包含四个氨基酸残基的芳香团簇,R16有两个(五个氨基酸残基),R17有三个(七个氨基酸残基)芳香团簇(图2A)。为了在谱域中找到柔性和刚性区域,我们计算了每个残基有序或无序的概率(图2B)。从图2B可以看出,R15、R16和R17的残基平均无序概率分别为0.59、0.49和0.38。因此,结构域R15比R16和R17更灵活,其中5个和7个芳香残基包含在芳香簇中。因此,我们可以认为R15的机械稳定性应该低于其他两个已研究的结构域。为了验证这一假设,我们进行了定向分子动力学模拟。我们模拟了用恒力和恒速度拉伸这些谱域的过程。从定向分子动力学模拟的结果我们可以得出结论,R15的机械稳定性不如R16, R16的稳定性不如R17(图1),但这三个谱域具有相同的展开途径。

因此,通过研究R15、R16和R17的结构和力学性能,我们发现它们具有不同的力学稳定性。R15的机械稳定性不如R16, R16又不如R17。光谱结构域16和17具有较高的机械稳定性,这可以解释为在芳香团簇中存在较多的刚性区和芳香残基。因此,谱域越机械稳定,其柔韧性越弱。
Anna V. Glyakina, Oxana V. Galzitskaya
俄罗斯科学院蛋白质研究所,普希奇诺,莫斯科官方manbetx手机版142290
出版
光谱结构域R15、R16和R17的力学展开比较研究。Glyakina AV, Likhachev IV, Balabaev NK, Galzitskaya OV
生物工程学报。2018年2月











留言回复
你一定是登录发表评论。