激活:对Treg来说是一把双刃剑
调节性T细胞(Tregs)是T细胞的一个特殊子集。顾名思义,它们在控制和调节其他免疫细胞方面发挥作用。Tregs以叉头/翼螺旋转录因子Foxp3的表达为特征,在胸腺(tTregs)或外周(pTregs)中产生。Foxp3在Treg中的持续表达对于Treg的身份和抑制功能至关重要。之前,我们发现Tregs可以关闭Foxp3的表达,并重新编程为其他T效应亚群。这种从免疫抑制细胞到免疫增强细胞的转变对理解各种自身免疫性疾病和过敏的发病机制具有重要意义,并可能提供对抗肿瘤的新策略。然而,胸腺源性ttreg是否能够下调Foxp3仍不清楚。
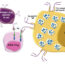
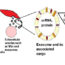
最近的研究结果表明,Foxp3基因位点内保守的非编码DNA序列1 (CNS1)对诱导ptreg的产生至关重要,但对tTreg的发育却必不可少。因此,我们开发了Foxp3 ΔCNS1-Cre小鼠报告菌株,该菌株允许通过Thy1.1标记ttreg进行鉴定和谱系追踪。对该转基因小鼠的表型分析表明,报告基因Thy1.1标记了胸腺中成熟和表观遗传的treg细胞。通过使用这种新型的tTreg命运定位小鼠,我们发现只有约1%的成熟tTreg在次要淋巴器官中失去Foxp3表达,这表明tTreg在稳态条件下是稳定的。然而,TCR参与和ttreg的顺序功能专门化导致Foxp3不稳定的产生,并重新编程为T辅助谱系。我们进一步证明,在Treg激活过程中,从IL-2到ICOS的信号转换导致Treg不稳定和重编程。最后,利用同时开启Foxp3和T-bet遗传追踪的双谱系追踪小鼠模型,我们证明了T-bet在效应Tregs中的表达是不稳定的。失去T-bet表达的效应T-bet阳性Treg恢复到静息样Treg表型并稳定Foxp3表达。总之,我们的研究表明,TCR激活对Treg来说是一把双刃剑。激活过程是treg获得有效抑制活性的必要条件; however, over-activation can promote conversion of Tregs from immune-suppressing cells to immune-boosting cells.
在这里,我们提出了一个模型,表明Treg激活的信号强度和/或持续时间决定了效应Treg的不同命运(即免疫抑制与免疫增强)。传统T细胞和tTreg都是在胸腺中产生的,并经过一个复杂的过程,在这个过程中,TCR和apc上的自肽- mhc复合物之间相互作用的持续时间和强度决定了T细胞的命运。大多数高亲和力结合的胸腺细胞通过克隆性缺失来限制外周的自身免疫。然而,一些具有中等高亲和力的自激动剂配体优先发展treg,这是生物体对抗自身反应性的另一种保障。常规T细胞和treg细胞都有识别外周外来抗原的潜力。对于传统的T细胞,高亲和力的TCR-MHC结合可能优先产生显性T细胞克隆扩增来对抗感染。然而,类似的TCR-MHC参与Treg可能会诱导强烈的ICOS/PI3K信号,这不利于Treg抑制活性并终止Foxp3的表达。由于在胸腺阴性选择过程中,高亲和力的自肽- mhc被删除,相对较弱的自肽- mhc可能为ttreg提供了一个“刚刚好”的激活窗口。该模型可以解释treg倾向于抑制相对较弱的免疫反应,而相对低效地控制强免疫反应(如同种异体皮肤移植)的普遍现象。
张忠梅,周旭宇
中国科学院微生物研究所,北京
出版
调节性T细胞的激活和功能特化导致Foxp3不稳定的产生。
张忠,张伟,郭军,顾强,朱旭,周旭
免疫学杂志,2017年4月1日












留言回复
你一定是登录发表评论。