水飞蓟宾对牛胰岛素淀粉样蛋白纤颤的抑制作用及其毒性
内源性多肽(如β-淀粉样肽、tau蛋白、α-突触核蛋白和胰岛素)的错误折叠和随后聚集成富含β-sheet的组装是糖尿病和许多神经退行性疾病的潜在原因。虽然没有发现淀粉样蛋白前体肽和蛋白质之间的序列或结构相似性,但淀粉样蛋白原纤维具有一些共同特征,包括β-sheet丰富的结构和结合硫黄素T和刚果红染料的能力。这可能导致不同的肽和蛋白质遵循类似的纤维形成途径的建议。牛胰岛素是与人胰岛素具有显著结构同源性的最具特征的蛋白质之一(它们仅相差三个氨基酸),这与注射局限性淀粉样变性有关。
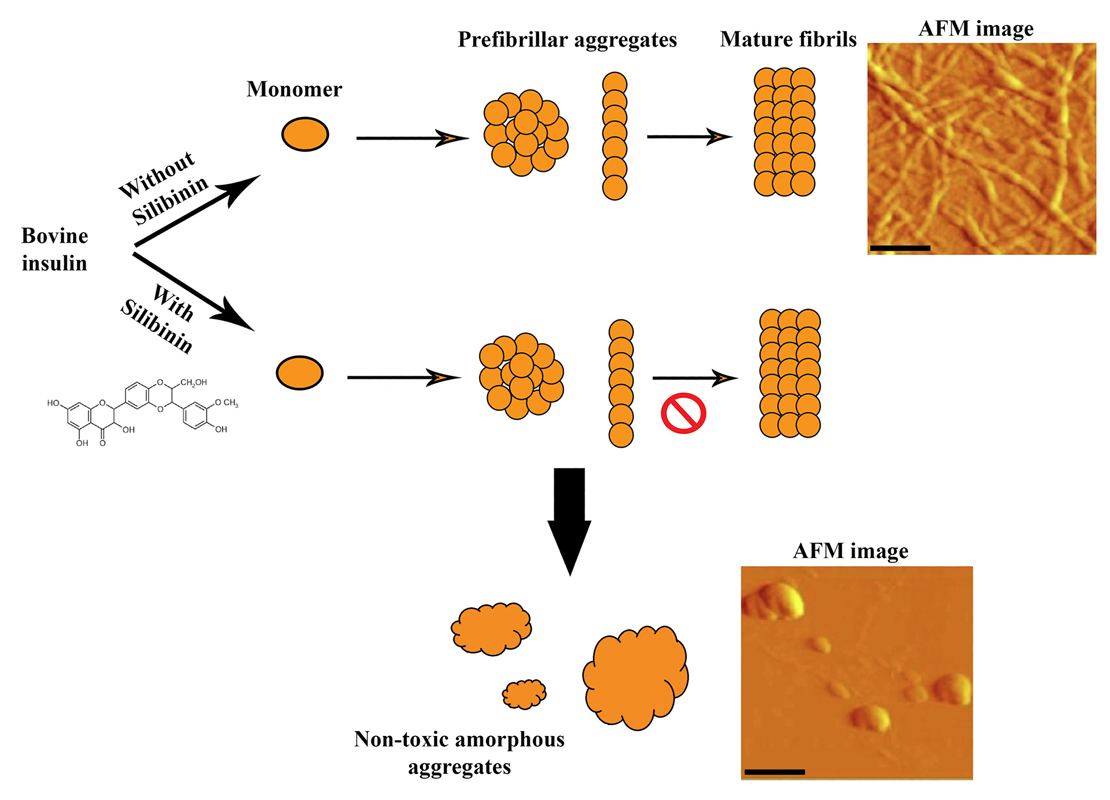
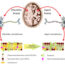
图1所示。水飞蓟宾对牛胰岛素淀粉样蛋白纤颤的抑制作用示意图。水飞蓟宾与牛胰岛素原纤维结合,改变其表面结构特征,并将聚集过程重定向到另一种无毒的无定形聚集途径。胰岛素单独或与水飞蓟宾孵育的AFM图像也显示。比例尺表示500 nm。
因此,牛胰岛素可作为研究淀粉样纤维形成机制的良好模型蛋白在体外。由于缺乏对淀粉样蛋白相关疾病的有效治疗,寻找能够有效抑制淀粉样蛋白原纤维形成的化合物可能是一种很有前途的治疗策略。在这方面,据报道,广泛存在于食物和草药中的天然多酚可以预防和/或延缓淀粉样蛋白原纤维,并减弱其相关的细胞毒性在体外和在活的有机体内。其中水飞蓟宾(水飞蓟宾)由于能够与多种淀粉样蛋白形成肽和蛋白质相互作用,包括β淀粉样蛋白、人胰岛淀粉样蛋白多肽和溶菌酶,从而有效地预防淀粉样蛋白纤维的形成而引起了人们的广泛关注。然而,其抑制淀粉样原纤维诱导的神经元细胞死亡的机制尚不清楚。在本研究中,水飞蓟宾的效力与相互作用和抑制牛胰岛素淀粉样蛋白颤动被研究了一系列技术特异性的淀粉样蛋白检测。基于所获得的结果,我们认为水飞蓟宾与牛胰岛素纤颤早期形成的淀粉样结构的结合显著改变了原纤维物种的表面结构特征,并将胰岛素聚集过程重定向到另一种无毒的无序(无定形)聚集途径(图1)。研究了水飞蓟宾对牛胰岛素淀粉样原纤维诱导的神经母细胞瘤SH-SY5Y细胞的细胞保护作用。根据乳酸脱氢酶(LDH)释放测定、活性氧(ROS)含量测定和碘化丙啶(PI)染色的结果,我们认为细胞膜通透性和线粒体功能障碍可能是牛胰岛素淀粉样原纤维发挥其细胞毒性的机制(图2A)。因此,我们提出牛胰岛素淀粉样蛋白原纤维诱导SH-SY5Y细胞的坏死(LDH释放证明质膜破坏)和凋亡(通过PI染色检测)变化(图2A)。
最后,通过一种涉及线粒体苹果酸脱氢酶(MDH)释放的方法,研究了在水飞蓟素缺失或存在的情况下老化的牛胰岛素纤颤产物(包括低聚物和纤维)与大鼠脑线粒体的相互作用。暴露于牛胰岛素纤颤产物后,线粒体MDH的释放(图2B)表明这些聚集物可以影响膜的通透性。另一方面,水飞蓟宾在减轻线粒体膜损伤方面非常有效(图2B)。总之,结果表明牛胰岛素原纤维能够通过诱导坏死/凋亡变化导致SH-SY5Y细胞死亡,并提示水飞蓟宾可能提供保护。因此,阐明这种保护作用可能为开发淀粉样蛋白相关疾病的预防和治疗药物提供重要的见解。
Bentolhoda Katebia, Mohsen Mahdavimehra, Ali Akbar Meratana, Atiyeh Ghasemib, Mohsen Nemat-Gorganic
基础科学高级研究所生物科学系,赞詹,伊朗
德黑兰大学生物化学与生物物理研究所,伊朗德黑兰
美国加州帕洛阿尔托斯坦福大学斯坦福基因组技术中心
出版
水飞蓟宾对胰岛素淀粉样蛋白纤颤、细胞毒性和线粒体膜损伤的保护作用
Katebi B, Mahdavimehr M, Meratan AA, Ghasemi A, Nemat-Gorgani M
Arch biochemistry . 2018年12月1日









留言回复
你一定是登录发表评论。