小分子对人血清白蛋白纤颤过程的协同作用
小分子与蛋白质及其聚集体相互作用的方式不同。其中之一是药物或小分子对蛋白质聚集体的协同作用。
蛋白质聚集是神经变性的常见原因。常见的变性蛋白主要有α-突触核蛋白、α- β肽、tau蛋白、朊蛋白等。
分子间相互作用,高温下人血清白蛋白(HSA)疏水性增加是其聚集机制,类似于α-突触核蛋白聚集机制。

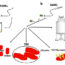
图1所示。HSA在25°C(单体)下的示意图显示没有纤维形成。(B)在65°C孵育168小时后形成成熟的离散淀粉样原纤维。(C)在相同条件下,HSA与BH共孵育(1:1)对淀粉样原纤维的部分抑制。(D)在相同实验条件下,HSA与LD(1:4)共孵育,大原纤维降解为小原纤维。(E) HSA与BH和LD同时在65°C下共孵育168 h,对淀粉样蛋白原纤维几乎完全抑制。
本研究观察发现,盐酸苯塞拉肼(BH)、左旋多巴(LD)同时加入到人血清白蛋白(HSA)样品中并在热条件下培养时,与单独使用药物相比,对淀粉样蛋白原纤维的抑制作用最大(图1)。
通过对两药联合指数(CI)的分析,证实了两药联合后活性增强的原因,其联合指数为0.39 (CI<1,协同作用)。这证实了BH和LD之间的协同作用。
进一步,在SH SY5Y细胞系上分析了这一假设。结果显示了相应的结果。与单独使用BH和LD相比,BH+LD对SH SY5Y细胞活力的影响更具建设性(图2)。

图2所示。SH-SY5Y细胞系168 h老化HSA淀粉样原纤维在无BH、LD和两者同时存在时细胞毒性的MTT还原试验。结果为三个独立实验的平均值(n =3),误差条表示标准差。*治疗前后HSA原纤维、细胞形态图像与对照组比较,p < 0.05,差异有统计学意义。
因此,与传统的抑制淀粉样蛋白原纤维的机制相比,协同作用是一种更有前途的现代抑制机制。
Tajalli Ilm Chandel, Rizwan Hasan Khan
印度北方邦阿里格尔阿里格尔穆斯林大学跨学科生物技术部
出版
抗帕金森药物对人血清白蛋白纤颤增效作用的多参数分析
Tajalli Ilm Chandel, Nida Zaidi, Masihuz Zaman, Ishrat Jahan, Aiman Masroor, Ibrar Ahmad Siddique, Shahid M Nayeem, Maroof Ali, Vladimir N Uversky, Rizwan Hasan Khan
生物化学学报,2019年3月











留言回复
你一定是登录发表评论。