骨髓内基因网络作为造血和感染的纽带
免疫系统配备了有效和可调的机制,可以立即从我们体内清除病原体。血液中的微生物入侵是一种紧急状态,因为它们会引发炎症反应,导致败血症。因此,造血干细胞和多能祖细胞(HSPCs)作为血细胞的来源,表达包括脂多糖(LPS)在内的微生物成分传感器,以监测血液中入侵微生物的外观。当HSPCs接受来自微生物的信号时,它们增强向巨噬细胞和粒细胞(骨髓细胞)的分化能力,以消除微生物。
HSPCs分化为不同类型细胞的命运受转录因子的调控。据报道,转录因子Bach2和Bach1可抑制普通淋巴祖细胞(CLPs)的髓系基因。这种抑制对于B细胞从CLPs分化是重要的(Itoh-Nakadai, A. et al, Nature Immunology, 15,1171 -, 2014)。通过抑制髓系基因选择替代命运导致了内髓系的想法,该想法认为髓系分化是造血干细胞分化的原型,默认途径(Igarashi K和Itoh-Nakadai, A. Curr Opin Immunol. 39, 136-142, 2016)。
为了阐明髓系基因抑制剂Bach2是否在造血干细胞中也具有功能,我们计算了造血干细胞和祖细胞的数量Bach1- / -Bach2- / -老鼠。淋巴样祖细胞数量减少Bach1- / -Bach2- / -与野生型小鼠相比,造血干细胞和多能祖细胞(mpp)的数量没有改变。有趣的是,Bach2- / -HSPCs分化为B220的能力受损+CD19- - - - - -B祖细胞下在体外B细胞分化培养,显示髓细胞分化增强。相反,Bach2的过表达促进了B220的发育+CD19- - - - - -来自mpp的B祖细胞。这些观察结果表明,Bach2促进了造血干细胞中淋巴细胞祖细胞的发育。
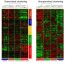
为了了解Bach2在HSPCs中的基因调控网络(GRNs),我们搜索了Bach2靶基因。促进髓细胞分化的转录因子C/EBPβ和Irf8编码基因被Bach2直接抑制。此外,Bach2抑制Csf1r编码巨噬细胞集落刺激因子(M-CSF)受体有趣的是,我们发现C/EBPβ抑制Bach2Gene和promote thatCsf1r基因。发现Bach2和C/EBPβ结合髓系和淋巴系基因的相似基因组区域,分别抑制或激活它们的共同靶基因。因此,在HSPCs中,Bach2和C/EBPβ通过反向调节淋巴细胞和髓细胞基因来调节淋巴细胞和髓细胞分化的平衡,并相互抑制外周基因和自身基因(图1)。GRN的这种结构可能提供获得性和先天免疫的平衡,对环境扰动有快速的反应。
事实上,众所周知,C/EBPβ在LPS的作用下上调。为了探讨Bach2-C/EBPβ GRN在感染下造血功能中的作用,我们通过注射LPS模拟感染野生型和Bach2- / -老鼠。LPS处理一周后,野生型小鼠骨髓中髓样细胞百分比比对照小鼠增加,淋巴样细胞百分比下降。值得注意的是,Bach2- / -小鼠对LPS的反应显示髓样细胞的频率(83.7%)显著高于野生型小鼠(63%)。相比之下,B细胞数量减少更严重Bach2- / -与野生型小鼠相比LPS下调HSPCs中Bach2基因的表达,相反上调C/EBPβ基因的表达在体外.重要的是,在LPS刺激的HSPCs中,与Bach2和C/EBPβ共享靶基因的M-CSF受体基因显著升高。综上所述,Bach2-C/EBPβ GRN在LPS刺激下限制髓细胞分化。
除了通过细胞因子网络调节造血和免疫系统外,本研究清楚地表明,细胞内在的Bach2 GRN对环境扰动作出反应,从而调节造血(图2)。GRN的成分可能提供免疫细胞相关疾病的治疗靶点。
Ari Itoh-Nakadai1,Kazuhiko Igarashi)2
1中国科学院发展、衰老与癌症研究所实验免疫学研究室,
日本仙台东北大学
2东北大学医学院生物化学系,日本仙台
出版
多能造血祖细胞的Bach2-Cebp基因调控网络。
中代伊藤A,松本M,加藤H,佐佐木J,上原Y,佐藤Y, Ebina-Shibuya R, Morooka M,船山R,中山K,尾井K,武藤A, Igarashi K
Cell rep 2017 3月7日













留言回复
你一定是登录发表评论。