P2X7拮抗剂:降低人类动脉粥样硬化血管炎症状态的特定工具?
动脉粥样硬化是一种动态进展的大动脉疾病,其特点是脂质、炎症细胞、平滑肌细胞和细胞外基质倾向于在内皮下空间内积聚,并以不可预测的方式向不同阶段发展。动脉粥样硬化斑块(PL)的破裂或侵蚀最终导致缺血性事件,如心肌梗死和中风,在世界范围内与高致残率和死亡率负担相关。细胞外基质成分合成与分解的不平衡,通过促进病变部位增殖细胞的迁移和动脉粥样硬化纤维帽的变薄,在斑块的进展与不稳定中起着重要作用,并增加了破裂和血栓形成的可能性。高度炎症的PL显示基质金属肽酶(MMPs)活性升高。特别是高基质金属蛋白酶-9活动在不稳定的颈动脉中检测到吗PL (CPL).MMPs从循环细胞中激活或释放涉及嘌呤能受体通道7型(P2X7)的激活,这是一种由细胞外三磷酸腺苷激活的配体门控阳离子通道。循环细胞上的P2X7可能参与了健康血管和动脉粥样硬化血管凝血的触发/增殖,并有助于小鼠组织因子依赖性血栓形成。该受体的功能广泛且部分未知,但其在动脉粥样硬化进展中的病理生理作用已被假设。已发表的令人信服的证据表明,atp触发的P2X7途径通过微囊泡或溶酶体介导IL-1β的加工/释放。P2X7在CPL中的表达高于非动脉粥样硬化性动脉。

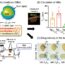
图1所示。该研究的示意图,说明了P2X7拮抗剂A740003对IL-1β产生和释放以及MMP9产生的作用机制。(改编自Lombardi M, Mantione ME等人。科学进展,2017;7(1):4872。
我们假设P2X7在依赖il -1β的MMP9调控中发挥作用,并最终在CPL不稳定的调节中发挥作用。
我们研究了通过作用于P2X7对白细胞介素1β (IL-1β)释放和MMP9生成的调节。
P2X7和相关的血管谱(IL-1β、NLR家族pyrin结构域3、caspase-1和MMP9)进行了表征。采用分子生物学、免疫生化和显微镜方法研究了P2X7拮抗剂(A740003、KN62)和MMPs抑制剂(Batimastat、Ro28-2653)在人CPL与非动脉粥样硬化性乳腺内动脉(IMA)离体组织培养中的作用。我们强调了CPL和IMA分子模式之间与动脉粥样硬化相关的差异,以及它们对P2X7拮抗剂的反应。所有P2X7亚型(54kD、75kD和>100kD)在CPL中都有不同程度的检测到,但在IMA中只检测到54kD的P2X7亚型。分散P2X7+IMA共聚焦显微镜观察到沿管腔的细胞和管壁内的信号痕迹,而P2X7在管腔部位,在CPL的新生内膜和介质中均检测到,在αSMA中呈颗粒状+和CD68+细胞,以及周围的间质空间。在CPL组织中检测到IL-1β基因和蛋白,IMA和所有培养上清中均不存在或含量可忽略不计。高IL-1β组织含量与薄纤维帽下钙化结节的存在有关,并且CPL具有不稳定性/易感性特征。CPL提取物的MMP9含量和凝胶溶解活性高于IMA提取物。CPL也比IMA释放更多的MMP9到培养上清液中。
我们提供的证据表明,用A740003而不是KN62治疗离体培养的CPL,可以降低组织和上清液中的IL-1β和MMP9,独立于NLR家族pyrin结构域3,但与患者的吸烟状况有关。MMPs抑制剂降低IL-1β基因表达,但对MMP9无效,可能是因为患者认为他汀类药物。
这些数据证明了P2X7拮抗剂对CPL离体组织培养的有效性,表明A740003可能是一种降低人类血管炎症状态的特异性工具。这些结果可能支持P2X7拮抗剂用于动脉粥样硬化局部靶向和定制治疗的研究设计。
Chiara Foglieni, Maria Lombardi, MariaElena Mantione
意大利米兰,IRCCS圣拉斐尔官方manbetx手机版科学研究所心血管研究区
出版
P2X7受体拮抗剂调节人动脉粥样硬化血管中的IL-1β和MMP9。
Lombardi M, Mantione ME, Baccellieri D, Ferrara D, Castellano R, Chiesa R, Alfieri O, Foglieni C
2017年7月7日
相关文章:
|
气体类型影响微泡的稳定性和超声…超声(US)用于临床诊断和治疗。微泡(mb)作为超声造影剂用于检测微血流或特定病变。最近,MBs和… |
|
一种性能更好的…阿尔茨海默病(AD)是一种无法治愈的疾病,它会导致记忆力、推理能力和思维能力随着时间的推移而恶化。阿尔茨海默病的特征是脑萎缩和小肽的斑块样沉积。 |

|
膝关节前外侧韧带-解剖…1879年,保罗·塞贡德发表了一篇关于在扭伤的膝关节中临床出现和实验产生的血液的文章。作为一个相关的加重,他报告了粉碎性骨折的形成… |

|
长期的不可预测的环境压力对……有害。压力是指精神和情绪状态从正常的内稳态变化。换句话说,我们可以说压力发生在我们担心某事和感觉…… |

|
土壤和水生物工程-可持续侵蚀…加速的土壤侵蚀和流失是一个严重的环境问题,特别是对地中海区域而言,这是由于其长期的人类压力、季节性的气候差异和崎岖的地形。人为… |
|
脂质随着衰老和神经退化而不断萎缩我记得中学的生物老师第一次向我们介绍活细胞的生化成分。我立刻就被…… |







留言回复
你一定是登录发表评论。