低温电子显微镜在药物开发中的应用
低温电子显微镜(cryo-EM)正在成为膜蛋白结构测定的首选方法,并在基于结构的药物发现(SBDD)中具有巨大的潜力。Cryo-EM提供膜蛋白的高分辨率结构信息,而不需要结晶。它使用少量的纯蛋白质样品(微克而不是x射线晶体学所需的毫克),并且与难以结晶的不稳定膜蛋白兼容。

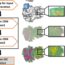
图1所示。低温电子显微镜研究受体:药物相互作用。GPCR:G蛋白复合物的电子显微照片(中)代表了几千张这样的显微照片中的一张,这些显微照片被处理以产生蛋白质的密度图;GPCR:G蛋白复合物(左)和五聚体离子通道(右)。通过冷冻电镜获得的每种受体的药物结合模式示例显示在其各自的冷冻电镜模型周围。小分子用棒状表示,蛋白质用卡通表示。
基于分子如何融入受体结合袋的三维原子信息,SBDD是合理设计和优化候选药物的有力途径。Cryo-EM现在为获得膜蛋白等高价值药物靶点的结构信息提供了新的可能性。与晶体学相比,Cryo-EM对于SBDD仍然存在一些限制,例如低通量、低自动化水平和常规实现的较低分辨率。然而,低温电镜更有可能产生膜蛋白的第一个结构,这将提供有关功能机制和可药物结合袋的关键信息。在这篇综述中,我们重点介绍了通过低温电镜技术获得的关于γ-氨基丁酸A受体(GABA)两个具有确定治疗价值的蛋白家族的见解一个Rs)和G蛋白偶联受体(gpcr)。
GABA的一个Rs是介导脑内抑制性神经传递并感知GABA和神经类固醇的离子通道。它们的功能障碍导致多种神经和精神疾病,因此是包括麻醉剂和苯二氮卓类药物在内的各种药物的目标。伽马氨基丁酸一个Rs是异戊二胺受体,主要分布在突触上,由两个a亚基、两个b亚基和一个g亚基组成。虽然x射线晶体学已经提供了对同质离子通道的见解,但生理上的异质离子通道是理解药理学所必需的。Cryo-EM提供了异质GABA的结构一个R通道与GABA(内源性激动剂)、苯二氮卓类药物(正变构调节剂)、氟马西尼(变构苯二氮卓类药物的拮抗剂)、微毒素(孔阻滞剂)和双库兰(竞争拮抗剂)等化合物配合,解释了这些药物的结合方式和作用机制。一些GABA一个受体嵌入脂质纳米盘中获得R结构,这似乎是唯一一种包含g亚基的天然异质通道采用非人工构象的方法。
GPCRs是人体中最大的受体家族,也是34%的FDA批准的小分子药物的靶标。gpcr感知多种细胞外信号,并通过偶联和激活异源三聚体G蛋白将信息传递到细胞质中。虽然x射线晶体学已经获得了关于gpcr的无活性/活性中间状态的信息,但处于完全活性状态的G蛋白结合受体却更加难以捉摸。gpcr活性状态的结构对于设计激活受体的药物(激动剂)或激活受体开启特定信号通路的药物(偏倚激动剂)是非常必要的。在不需要结晶的情况下,冷冻电镜已经生成了与不同G蛋白结合的受体结构年代G我和Go)和B类和C类受体,通过x射线晶体学难以处理。这些结果为GPCR:G蛋白偶联特异性、受体活性修饰蛋白(Receptor-Activity修饰protein, RAMPs)对GPCR的变构调节以及受体的激活模式提供了见解。
哈维尔García-Nafría,克里斯托弗·g·塔特
萨拉戈萨大学复杂系统生物计算与物理研究所(BIFI)和Microscopías Avanzadas实验室,50018,西班牙萨拉戈萨
分子生物学MRC实验室,弗朗西斯克里克大道,英国剑桥cb20qh
出版
冷冻电子显微镜:超越x射线晶体结构的药物受体和药物开发
哈维尔García-Nafría,克里斯托弗·G·塔特
2020年1月6日











留言回复
你一定是登录发表评论。