通过萤火虫荧光素酶催化步骤的互补分析蛋白质-蛋白质相互作用
蛋白质-蛋白质相互作用(PPI)分析是从基础分子生物学到诊断和药物开发等各个领域的关键技术。以前,PPI检测一般采用荧光共振能量转移(FRET)、生物发光共振能量转移(BRET)和蛋白片段互补(PCA)。基于FRET和bret的分析方法是既定的方法,其重复性高。为了进行这些检测,通常使用荧光蛋白和荧光素酶,然而,由于信号强度与6负相关,大蛋白之间的相互作用难以检测th探测器之间距离的功率。此外,可达到的信号/背景(S/B)比率相当低。另一方面,PCA是一种用户友好的分析方法,具有较高的S/B比,并且可以使用许多酶和荧光蛋白。然而,由于探针的分裂形式,信号强度和稳定性较低。
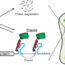
为了克服这些传统方法的问题,我们利用萤火虫荧光素酶(Fluc)反应的独特性质开发了一种新的PPI测定方法。也就是说,Fluc的发光反应可以分为两个半反应,即腺苷酸化步骤和随后的氧化发光步骤。在腺苷化过程中,d -荧光素与ATP反应生成中间产物荧光素-腺苷酸(LH)2-AMP),而在接下来的步骤中LH2-AMP加入氧,脱羧,转化为发光的氧荧光素(OxL)。为了检测PPI,我们制作了两个自身没有发光活性的突变体Flucs。一种叫做供体的突变体在转化LH方面有缺陷2-AMP到OxL。另一方面,另一种被称为Acceptor的突变体在将d -荧光素和ATP转化为LH方面存在缺陷2amp。当供体和受体各自与相互作用的蛋白质融合,并由于相互作用而接近时,供体提供LH2-AMP到受体,受体产生OxL发光。我们将这种PPI试验命名为fireflyluminescent我山米ediate-basedprotein我nteraction一个ssay FlimPIA。
菲律宾已经表现出几个优点在体外PPI化验。首先,与FP-FRET法和Fluc PCA相比,可以检测到较大蛋白质之间的相互作用,因为FlimPIA的信号强度随着探针之间的距离降低得更慢。其次,获得的S/B比高于其他测定法。三是PPI的检出限最低。第四,探针的稳定性高于Fluc PCA,这可能是由于使用了全长酶作为探针。第五,信号强度高于Fluc PCA。尽管flipia表演了在cellulo目前提供的好处较少,我们相信很快就会改进。
flipia是基于补偿酶的催化步骤的独特原理。Fluc属于酰基/腺苷酸形成酶超家族。该超家族酶催化的化学反应均由两个半反应组成,其中包括一个腺苷化步骤,其中将应用FlimPIA原理。希望通过使用该酶家族中的其他酶,可以开发出更有用的PPI测定方法和其他应用。
大室松山由纪,上田宏
日本东京大学工学院化学与生物技术系
化学资源实验室,东京工业大学,日本横滨
出版
通过铰链区工程和优化反应条件,获得了基于萤光素酶的超灵敏蛋白相互作用测定(FlimPIA)。
栗原M,大室松山Y, Ayabe K,山下T,山司H,上田H
2016年1月












留言回复
你一定是登录发表评论。