神经肌肉疾病药物开发的新策略
肌萎缩性侧索硬化症(ALS),也被称为Lou Gehrig病,是一种神经退行性疾病,脊髓和运动皮层的运动神经元(MN)丢失导致进行性瘫痪、肌肉萎缩和死亡。到目前为止,只有少数药物被美国食品和药物管理局批准作为ALS的对症治疗药物。然而,现有的药物缺乏有效性,只有有限数量的候选药物被评估用于治疗ALS。

缺乏现有治疗方法的一个主要原因是,目前传统的药物开发过程(2D培养模型然后进行动物实验)效率非常低。的确,尽管这些传统在体外培养方法已经导致了与ALS相关的重要发现,但缺乏模拟人类疾病的筛选模型严重限制了确定新药物靶点的能力。
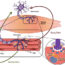
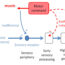
我们提出了一种利用“器官芯片技术”模拟生理和病理神经肌肉器官系统的新策略,用于ALS等神经肌肉疾病的药物筛选(图1)。通过这种新方法,我们建立了两个模型,一个是使用非ALS患者来源的MNs和ipsc来源的骨骼肌细胞的健康人体运动单元,另一个是来自ALS患者的MNs。
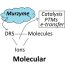
在这项工作中使用的运动神经元转染了通道rhosopsin2-[H134R],这是一种可用于控制神经元活动的光激活离子通道。这种光遗传技术在神经科学领域是一种非常普遍和有用的工具。通过这种光刺激,MN的信号通过轴突和神经肌肉接点传播到肌束,引起肌肉收缩。我们可以测量这种肌肉收缩力以及光刺激和肌肉收缩的同步,作为肌肉健康的读数。通过肌肉收缩对三维柱状结构的位移进行后期图像处理,计算肌肉收缩量。利用这两个参数,我们可以预测MN的状况、肌肉的成熟度以及两个组织的连通性。此外,候选药物可以通过使用新的或现有的药物来测试这种疾病模型。在本文中,我们发现“博舒替尼”和“雷帕霉素”两种药物及其联合使用改善了肌萎缩侧索硬化症运动单元的肌肉收缩力和mn -肌同步。通过这样做,我们能够复制在传统但更复杂和昂贵的动物实验中观察到的锰的恢复。我们使用als芯片模型的发现支持了这些药物的潜力,特别是在联合使用时。 This drug screening method is novel in that the traditional model for drug development only considered the health and function of the neurons and/or motor neurons. No previous studies investigated the effects on skeletal muscle nor and the interaction between MN and skeletal muscle cells in the drug screening process, despite the fact that ALS is known to be associated not only with motor neurons but also skeletal muscle.
在这项研究中,我们使用了正常的人类骨骼肌组织。如果我们转而使用患者来源的骨骼肌细胞,我们相信我们的模型不仅可以应用于神经病变(如与ALS和脊髓性肌萎缩症相关的疾病),还可以应用于肌病(如与杜氏肌萎缩症和重症肌无力相关的疾病)。通过形成患者来源的肌纤维束,我们可以研究肌肉萎缩和MN活动之间的相互作用,从而对这些疾病进行药物测试。最后,由于阿尔茨海默病、帕金森病和癫痫与肌肉力量的丧失有关,与这些患者的ipsc来源的皮质神经元共培养可能有助于研究这些病理与肌肉力量之间的关系。
研究所达Osaki
美国麻省理工学院机械工程系
出版
肌萎缩性侧索硬化症(ALS)的微生理3D模型,由人类ips来源的肌肉细胞和光遗传运动神经元构建。大崎T, Uzel SGM, Kamm RD
2018年10月10日










留言回复
你一定是登录发表评论。