用于肝脏研究的超纯细胞官方manbetx手机版
在世界范围内,肝纤维化、肝硬化和肝细胞癌给人类带来了巨大的痛苦和沉重的经济负担。肝星状细胞(hsc)占肝细胞总数的5-8%,是导致病变肝脏内多余疤痕组织积累的原因。在正常肝脏中,这些细胞是静止的,含有大量储存维生素a的脂肪液泡。肝损伤后,这些细胞失去其静止的表型,并转分化为高度增殖的肌成纤维细胞,能够合成和沉积大量胶原。由于其特殊的病理生理相关性,HSC生物学一直是许多研究的焦点。1982年已经建立了第一个HSC分离方案。在各自的方案中,肝脏首先通过灌注系统由蛋白酶和胶原酶酶消化,然后通过密度梯度对粗肝细胞悬浮液进行离心富集造血干细胞。

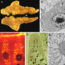
图1所示。小鼠HSC分离的简化方案。第一步,用不同的酶灌注溶液灌注麻醉小鼠的肝脏。随后,取出肝脏,将细胞分散在无菌塑料培养皿中。然后,对细胞液进行过滤,用密度离心富集造血干细胞。离心后,hsc位于白色闪光的中间层,而肝细胞和其他血细胞主要位于梯度的底部。然后在FACS机器中进行造血干细胞的最终纯化,通过355nm激光的紫外光激发和测量细胞内视黄醇(维生素a)含量在505 nm处产生的发射来鉴定造血干细胞。
在离心过程中,造血干细胞因其高脂含量和伴随的低密度而与其他细胞(剩余的肝细胞、库普弗细胞、窦内皮细胞)分离。离心结束时,hsc富集的低密度部分可见为薄白色层。由于足够的细胞脂滴是成功分离HSC的重要先决条件,这些方案在使用相对较老的小鼠或当动物接受富含维生素a的饮食时效果最好。当然,这些方案多年来对HSC生物学的知识做出了重大贡献。然而,很明显,这些传统的方案完全基于细胞密度的差异,只允许细胞的富集(高达50-70%),并且远远不能产生几乎纯的细胞制剂。因此,当用分子生物学和生物化学中可用的无限多的新颖、高灵敏度技术分析这些细胞混合物时,可能会出现相当大的陷阱。
我们最近描述了一种高纯度分离小鼠造血干细胞的先进方法(图1)。与以前的方案类似,肝脏首先用蛋白酶和胶原酶酶解以破坏实质性细胞。之后,通过由碘己醇(一种被批准用作造影剂的化合物)制成的梯度对粗细胞混合物进行密度离心,以富集造血干细胞。然后,荧光活化细胞分选(FACS)进一步纯化富含HSC的细胞部分,使用配备适合检测细胞内维生素a含量引起的HSC自身荧光的紫外激光器的FACS分选仪器。对于HSC分选,采用门控策略,首先区分细胞双态,然后将单个细胞暴露在紫外激光下并通过其紫外光激发曲线进行识别。用不同的抗体对其他污染细胞群(包括白细胞(CD45)、中性粒细胞(Ly6G)和巨噬细胞(CD11b和F4/80)上的特定标记物进行染色,可以进一步用于识别污染细胞。总之,这种分选策略非常适合鉴定和分离高纯度的造血干细胞,并可靠地从所有髓细胞中分离出造血干细胞。重要的是,当需要从一个肝脏中同时分离不同的细胞群时,我们的方案也很有用,从而允许对来自同一动物的不同肝细胞区室进行全面比较。此外,包括FACS分选在内的新方法适用于从损伤和纤维化肝脏中分离hsc,扩大了在病变肝脏和模拟人类肝脏疾病的小鼠模型中研究hsc生物学的实验可能性。虽然我们必须承认,与传统的分离方法相比,这种方法获得的总细胞产量要低得多,但这种方法是建立纯HSC培养所需的分析技术的理想方法,目的是揭示HSC的转录组学或表观基因组学景观,而不受干扰因素的影响。
Sabine Weiskirchen, Ralf Weiskirchen
分子病理生物化学研究所,
实验基因治疗与临床化学(IFMPEGKC);
亚琛工业大学医院,D-52074,德国亚琛,Pauwelsstr. 30
出版
小鼠肝星状细胞的分离与培养。
Weiskirchen S, Tag CG, Sauer-Lehnen S, Tacke F, Weiskirchen R
方法《Mol Biol》,2017












留言回复
你一定是登录发表评论。