RAS mRNA g -四重体:使不可药物的癌症靶点可药物化
在许多癌症中,RAS蛋白通过它们的致癌突变或上游分子的激活而被组成性激活。RAS蛋白在癌细胞恶性肿瘤中起着核心作用,因此靶向RAS的药物被认为是治疗许多癌症的有希望的药物。然而,由于RAS蛋白的结构特点,一般认为化合物靶向RAS蛋白比较困难。为了通过使用分子靶向药物使RAS功能失活,我们已经靶向拉而不是RAS蛋白本身。值得注意的是,富含鸟嘌呤的g -四重体(G4)形成序列存在于鸡的5 ' -非翻译区(UTR)国家管制当局方面mRNA,它编码一个主要的RAS亚型。
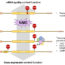
首先,我们研究了阴离子酞菁与锌作为配位金属(ZnAPC)的结合特性,并研究了从g4形成序列衍生的g -四聚体形成RNA寡核苷酸国家管制当局方面mRNA (NRAS G4)。我们发现,即使存在多余的双链RNA, ZnAPC也能结合NRAS G4。考虑到活细胞中存在大量的双链RNA分子,这些结果表明ZnAPC能够与g -四重体结合国家管制当局方面特别是在细胞中的mRNA。ZnAPC的光敏性也为其作为分子靶向药物的功能提供了前景。光敏剂受光激发的电子能量被转移到氧分子中,导致活性氧(ROS)的产生,这通常会引起DNA和RNA的裂解(图1)。众所周知,从活性酞菁到氧的电子转移效率在单体形式比在低聚形式要高得多。在水溶液中,ZnAPC分子以低聚形式存在,而单体形式通过与NRAS G4结合而诱导,导致NRAS G4在光照射下裂解。我们进一步证明,即使在缺氧条件下,ZnAPC也能够光裂解NRAS G4。这些结果表明,光激活的ZnAPC直接切割NRAS G4(图1)。ZnAPC对NRAS G4的结合亲和力与其对应的DNA (NRAS DNA G4)相似,而光激活的ZnAPC对NRAS G4的切割效率远高于对NRAS DNA G4的切割效率。这些结果表明NRAS G4是通过RNA的2¢核糖羟基的h萃取而被切割的。
根据这些在体外结果,ZnAPC降低了国家管制当局方面MCF-7细胞mRNA和NRAS蛋白的表达,并在处理24 h后将其存活率降低至5% (ZnAPC和光照射)。此外,我们发现国家管制当局方面ROS清除剂n -乙酰半胱氨酸(N-acetyl半胱氨酸,NAC)处理并不能挽救光照射后癌细胞因ZnAPC而死亡的mRNA和NRAS蛋白,这也与我们的研究结果一致在体外实验。

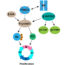
图2所示。利用ZnAPC进行分子靶向光动力治疗的示意图
ZnAPC通过静脉给药,选择性结合NRAS mRNA g -四重体。ZnAPC在近红外光照射下通过ROS的产生,通过能量传输直接降解NRAS mRNA g -四重体。NRAS基因在黑色素瘤等人类癌症中高度突变。ZnAPC是一种新型的靶向NRAS RNA g -四联体的光动力疗法。
光动力疗法(PDT)是公认的微创治疗方法。我们的研官方manbetx手机版究显示了使用ZnAPC作为癌症PDT光敏剂的优势(图2)。首先,ZnAPC通过其mRNA的分解下调NRAS蛋白的表达。二是下调调控国家管制当局方面即使在大多数光敏剂无效的低氧条件下,ZnAPC也能诱导mRNA。第三,ZnAPC对正常细胞的毒性较低,可以将光照射限制在癌组织内,远离正常区域。因此,基于我们的研究结果,利用ZnAPC分子靶向PDT治疗癌症是很有前景的在体外和在活的有机体内结果。
川内惠子,杉本渡,三吉大辅
科南大学科技创新研究前沿(FIRST),神户,6官方manbetx手机版50-0046
出版
阴离子酞菁通过分解RNA g -四重体来降低NRAS的表达。
川内K,杉本W,安井T,村田K,伊藤K,高木K,鹤冈T,赤松K,立石karimata H,杉本N,三吉D。
Nat common . 2018年6月11日










留言回复
你一定是登录发表评论。