Midkine通过调节VEGF的生物利用度来控制自然旁路生长
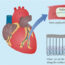
心血管闭塞性疾病,如中风、心肌梗死或血管周围动脉疾病(PAD)是一个主要的个人和社会负担。根据世界卫生组织,血管闭塞性疾病是世界范围内死亡的主要原因。目前最先进的治疗包括经皮腔内血管成形术(PTA),经皮腔内冠状动脉成形术(PTCA),或者,如果这些选择不可行,旁路手术。然而,从临床来看,众所周知,一些患者不需要这样的手术干预,因为他们从自然旁路的生长中获益(图1)。

这个被称为动脉生成的过程是由血液驱动的流体剪切应力触发的。当狭窄缓慢进展时,血流被重定向到先前存在的绕过闭塞动脉的侧枝小动脉。由于血流量增加,原有小动脉的内皮细胞被激活,最终导致血管的生长。在了解动脉形成的分子机制方面已经付出了很多努力,为开发旨在促进患者自然旁路生长的非侵入性治疗方案提供了基础。根据目前的科学状况,动脉生成是先天免疫的问题。它依赖于局部和暂时的炎症过程,这一过程连续涉及血小板、中性粒细胞、肥大细胞、T细胞和单核细胞的作用。最近,一种涉及血管内皮生长因子受体2 (VEGFR2)作用的机械传感复合体被发现与机械力(即流体剪切应力)转化为导致侧支动脉生长的各种生物和生化信号有关。血管内皮生长因子A (VEGF-A)是一种VEGFR2的配体,是一种有效的血管生成诱导剂,即毛细血管的发芽。然而,毛细血管不能代替动脉的损失,因为毛细血管不能将血液输送到全身,而只能局部为组织提供血液。VEGF-A是否也在动脉发生中起作用一直是争论的焦点。 Neither VEGF-A nor its receptor VEGFR2 is differentially expressed in (growing) collaterals. Moreover, administration of VEGF-A promoted arteriogenesis, if it all, only to a minor degree in animal models and in patients. Recently, it was shown that the source of VEGF-A for angiogenesis are neutrophils, and later on that leukocytes such as neutrophils and monocytes are also the source of VEGF-A for arteriogenesis. We were now able to show that the bioavailability of leukocyte derived VEGF-A is regulated by midkine. Midkine is a retinoic inducible cytokine, which is expressed during embryogenesis and under inflammatory conditions in adult organisms. Using a murine hindlimb model of arteriogenesis, our results evidenced that midkine mediated levels of VEGF-A are necessary and also sufficient to promote shear stress induced vascular cell proliferation and hence collateral artery growth by regulating the expression nitric oxide synthases (NOS) (Fig. 2).

在动脉形成过程中,VEGF-A诱导的VEGFR2同型二聚体信号受到共受体Neuropilin-1的严格调控。因此,问题出现了,辅助因子如细胞外RNA介导VEGF-A与VEGFR2和Neuropilin-1的相互作用并促进局部炎症是否可能增强外源性给药VEGF-A在促进动脉形成方面的有限作用。然而,要解决这个问题还需要进一步的研究。有趣的是,我们对midkine的研究表明,这种细胞因子的应用可能通过多受体复合物激活NOS,从而导致长期的血管舒张(图2)。因此,midkine可能是一种优于目前可用的血管舒张剂(如一氧化氮供体)的药物,后者由于快速耐受性,仅显示出有限的效果。
伊丽莎白Deindl
沃尔特-布伦德尔实验医学中心,大学医院,
慕尼黑大学,慕尼黑,德国
出版
Midkine通过调节血管内皮生长因子A的生物利用度和一氧化氮合酶1和3的表达来控制动脉发生。Lautz T, Lasch M, Borgolte J, Troidl K, Pagel JI, Caballero-Martinez A, Kleinert EC, Walzog B, Deindl E
EBioMedicine。2018年1月












留言回复
你一定是登录发表评论。