神经性疼痛的细胞镇痛控制功能障碍
传统上认为,小纤维神经病的神经性疼痛是伤害感受器损伤和致敏的结果。另一种观点也被提出:可能存在神经元镇痛控制系统的缺失,与致敏的伤害感受系统平行,导致神经性疼痛。这个过程可能涉及腺苷,腺苷是一种细胞镇痛效应,由腺嘌呤单磷酸(AMP)由前列腺酸性磷酸酶(PAP)水解而成,PAP是一种由前列腺合成的糖蛋白。PAP被认为具有外核苷酸酶活性,这对于响应病理生理细胞稳态至关重要。这样,PAP下调可能导致AMP/腺苷比例失衡,导致神经元镇痛控制功能障碍。事实上,最近的研究发现,PAP通常用于诊断前列腺癌,其分子特征与广泛用于标记伤害性背根神经节(DRG)神经元的硫胺素单磷酸酶相似。因此,在神经性疼痛的发展过程中,将PAP神经病理学和神经元镇痛系统的紊乱联系起来是合理的。

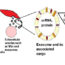
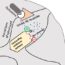
图1所示。前列腺酸性磷酸酶(PAP)在小纤维神经病变中调节痛觉的病理图。该图说明PAP病理介导疼痛发展遵循ngf - trka依赖的方式,如下步骤所述:(1)瞬时受体电位香草样蛋白亚型1 (TRPV1)被树脂干扰素(RTX)致敏,RTX是一种超强辣椒素。(2) RTX诱导PAP(+)神经元活化转录因子-3 (ATF3)上调,提示PAP病理。(3) PAP病理降低AMP水解。(4)由于腺苷镇痛作用的减弱,这种减少引起了痛觉。(5)神经生长因子(NGF)与高亲和力的NGF受体(trkA)结合,(6)逆转ATF3和PAP病理的诱导。(7)通过恢复AMP水解能力,恢复了AMP介导的镇痛作用。
皮肤中伤害性DRG神经元的外周靶点是表皮内神经纤维(IENFs),而IENF变性是小纤维神经病的主要病理特征。小纤维神经病IENF变性程度与神经元体损伤有关,可通过激活转录因子-3 (transcription factor-3, ATF3)标记。我们的研究发现,PAP在小到中等痛觉性DRG神经元中表达(25 - 75百分位数:17.1-23.7µm),在纯小纤维神经病变模型中,这些表达PAP的痛觉性DRG神经元数量减少,约30%被ATF3标记,表明它们经历了变性。PAP神经病理程度与机械异常性痛程度相关,机械异常性痛是小纤维神经病变的机械超敏症状。
伤害性DRG神经元在功能和形态上受不同神经营养因子和同源受体的调控。例如,神经生长因子(NGF)对伤害性DRG神经元具有营养作用,并通过其高亲和受体trkA调节神经性疼痛。然而,NGF是一种大分子蛋白,外源性NGF经常引起免疫反应。此外,从经济角度来看,商业纯化的NGF蛋白价格昂贵。Hanaoka et al .(1992)和Saita et al .(1995)发现一种小分子化合物4-甲基儿茶酚(4-methylcatechol, 4MC)可以促进NGF的合成。此外,我们的研究小组还证明了4MC促进IENF再生并逆转神经性疼痛。具体来说,我们发现由于PAP和TrkA的高共表达,4MC在逆转PAP病理和机械异常性痛方面是有效的。腹腔注射纯化的NGF蛋白的结果与4MC相似,并且4MC的作用被NGF中和消除。显然,4MC不仅能促进神经再生,还能促进刺激和/或损伤的小直径神经元体的恢复。我们目前的研究结果表明,神经元体细胞的损伤是刺激和/或损伤的基础,与细胞外核苷酸的代谢失衡相一致,这导致PAP镇痛作用的丧失。 Our findings also are the first to document an intervention against PAP pathology and NGF-trkA signaling, which mediates neuropathic pain. We suggest that restoring the analgesic ligand, and thereby maintaining static levels of adenosine and normal PAP ectonucleotidase activity in the neuronal soma, may offer a new direction for research into painful neuropathy.
综上所述,ATF3似乎是启动PAP镇痛作用丧失的上游分子,而NGF-trkA信号通路以trka依赖的方式恢复PAP的镇痛作用(图1)。
Yi-Chen李1,2,yu lin谢长廷1,2
1台湾高雄医科大学医学院医学院解剖学系
2台湾高雄医科大学附属医院医学研究部官方manbetx手机版
出版
表达:NGF-trkA信号调节前列腺酸性磷酸酶在树脂干扰素诱导的神经病变中的镇痛作用。
吴超,何伟,李玉春,林春玲,谢玉玲
Mol Pain. 2016年6月15日











留言回复
你一定是登录发表评论。